Перейти к:
Особенности ведения детей с кишечными стомами разной локализации в неонатальном периоде
https://doi.org/10.37489/2949-1924-0101
EDN: MBYUNI
Аннотация
Актуальной и сложной проблемой неонатологии является стомирование кишечника у новорождённых детей при тяжёлых заболеваниях и пороках развития желудочно-кишечного тракта. После операции не менее острая проблема — профилактика ассоциированных осложнений: больших энтеральных потерь по стоме, электролитных нарушений, синдрома мальабсорбции, холестаза, избыточного бактериального роста кишечной микрофлоры. Очень важна адекватная реанимационная помощь новорождённому с интенсивной стабилизацией состояния, полноценным мониторингом, коррекцией гомеостаза, контролем инфекции. После операции необходимо, наряду с парентеральным, рано начать энтеральное питание с трофического, расширяя его от возможностей сохранённого кишечника. Особенно важно иметь при этом грудное молоко и материнское участие в уходе за младенцем и стомой.
Для цитирования:
Куприянова Е.А., Мирзоева Я.С., Силуянова Н.Ю., Строева Л.Е. Особенности ведения детей с кишечными стомами разной локализации в неонатальном периоде. Пациентоориентированная медицина и фармация. 2025;3(3):40-49. https://doi.org/10.37489/2949-1924-0101. EDN: MBYUNI
For citation:
Kupriyanova E.A., Mirzoeva Ya.S., Siluyanova N.Yu., Stroeva L.E. Peculiarities of management of children with intestinal stomas of different localization in the neonatal period. Patient-Oriented Medicine and Pharmacy. 2025;3(3):40-49. (In Russ.) https://doi.org/10.37489/2949-1924-0101. EDN: MBYUNI
Актуальность
Экстренная патология новорождённых, при которой по жизненным показаниям накладывается кишечная стома, –– одна из актуальных проблем в неонатологии и неонатальной хирургии. В ней особое место занимает тактика лечения новорождённых детей с тонкокишечными стомами и вероятным синдромом «короткой кишки». Термин «стома» (греч. ostomy) обозначает хирургически созданное отверстие, соединяющее просвет внутреннего органа (в данном случае –– кишки) с поверхностью тела. Показаниями к наложению кишечных стом у новорождённых являются тяжёлые заболевания желудочно-кишечного тракта (ЖКТ) и/или врождённые пороки его развития. В тактике ведения детей с кишечными стомами важно выбрать оптимальную технику операции, обеспечить раннее восстановление пассажа содержимого по ЖКТ, профилактику осложнений, тщательное выхаживание пациента в послеоперационном периоде, в том числе, и уход за стомой. Необходимо обеспечить достаточное питание для оптимального роста младенца; минимизацию потерь жидкости, питательных веществ и электролитов; создать максимально возможные условия для кишечной адаптации. Особенно это актуально для детей угрожаемых по формированию интестинальной и/или печёночно-клеточной недостаточности. Соответствующее возрасту развитие новорождённых, профилактика и коррекция послеоперационных осложнений –– важная часть подготовки к реконструктивному этапу лечения и обеспечению качества дальнейшей жизни.
Цель работы
Обобщить опыт ведения новорождённых с кишечными стомами разной локализации и определить направления ранней системной абилитации в послеоперационном периоде для оптимизации адаптации ЖКТ и организма в целом к изменившимся условиям жизнедеятельности, что будет основой лучшего роста и развития младенца.
Материалы и методы
Проведён ретроспективный анализ 16-ти историй болезни новорождённых, которые получали лечение в ПИТ ОПННД, ОРИТННД и ОПННД ГБУЗ ЯО ОДКБ в 2019–2024 гг. Доношенных новорождённых было 56% (n=9), недоношенных 44% (n=7: с гестационным возрастом 28–31 неделя –– трое, 34–36 недель –– четверо). Девочки и мальчики представлены практически поровну, соответственно 56 и 44% (n=9 и 7). Сочетанной патологией у каждого третьего была асфиксия при рождении: умеренная у 31% (n=5), тяжёлая –– у 6% (n=1). У четверых пациентов выявлен ВПС (ДМЖП, ДМПП, аномальный дренаж лёгочных вен). Ещё у четверых –– гидронефроз.
Результаты и их обсуждение
Кишечная стома у всех пациентов была сформирована по жизненным показаниям: у 75% (n=12) –– в раннем неонатальном периоде, у 25% (n=4) –– в позднем. Показаниями к оперативному вмешательству и выведению стомы были: врождённый порок развития кишечника –– стеноз подвздошной кишки с кишечной непроходимостью –– 6% (n=1), атрезия ануса –– 45% (n=7), синдром Ледда 6% (n=1), болезнь Гиршпрунга 6% (n=1), мекониальный илеус 6% (n=1), врождённый перитонит 6% (n=1), энтероколит –– 25% (n=4). Из 12 случаев врождённой патологии кишечника пренатально были выявлены шесть (50%). У большинства пациентов в послеоперационном периоде отмечены нехирургические осложнения: холестаз (31%, n=5), синдром мальабсорбции (19%, n=3), избыточный бактериальный рост кишечной микрофлоры со снижением репаративных возможностей кишечника (25%, n=4). Хирургических осложнений было два (12%): у одного (6%) новорождённого в раннем послеоперационном периоде возникло кишечное кровотечение, также у одного (6%) в процессе выхаживания после операции выявлена несостоятельность одного из кишечных анастомозов. У всех младенцев (100%) имели место трудности грудного вскармливания, связанные прежде всего со стрессом, который испытывали матери в связи с болезнью ребёнка, а также с особенностями его кормления, необходимостью сцеживания молока и т. п.
В таблице 1 представлено расположение стомы при различной патологии у новорождённых.
Таблица 1. Расположение стомы при различной патологии у новорождённых Table 1. Location of stoma for various pathologies in newborns | |
Заболевание / врождённый порок | Наиболее частое расположение стомы |
Атрезия кишечника | Двенадцатиперстная, подвздошная или тощая кишка |
Атрезия ануса | Толстая кишка |
Синдром Ледда | Подвздошная или тощая кишка |
Мекониальный илеус | Подвздошная кишка |
Болезнь Гиршпрунга | Сигмовидная кишка |
Некротизирующий энтероколит | Подвздошная или тощая кишка |
Согласно данным литературы, у пациентов со стомами эффективность выхаживания, прогноз, негативные ближайшие и отдалённые последствия тесно связаны с длиной и функцией анатомического отдела, удалённого или отключённого кишечника [1, 2]. На рис. 1 схематично представлено расположение различных кишечных стом. В зависимости от уровня стомирования различают следующие их виды: энтеростома (стома, наложенная на тощую кишку), еюностома (из петли тощей кишки в верхней части тонкого кишечника), илеостома (из петли подвздошной кишки), колостома (соединяет толстую кишку с передней брюшной стенкой) [3]. В нашем исследовании тонкокишечную стому имели 50% (n=8) пациентов, колостому –– также 50% (n=8). В том числе, еюностомия выполнена у двоих, илеостомия –– у одного младенца, сигмостомия –– у троих.
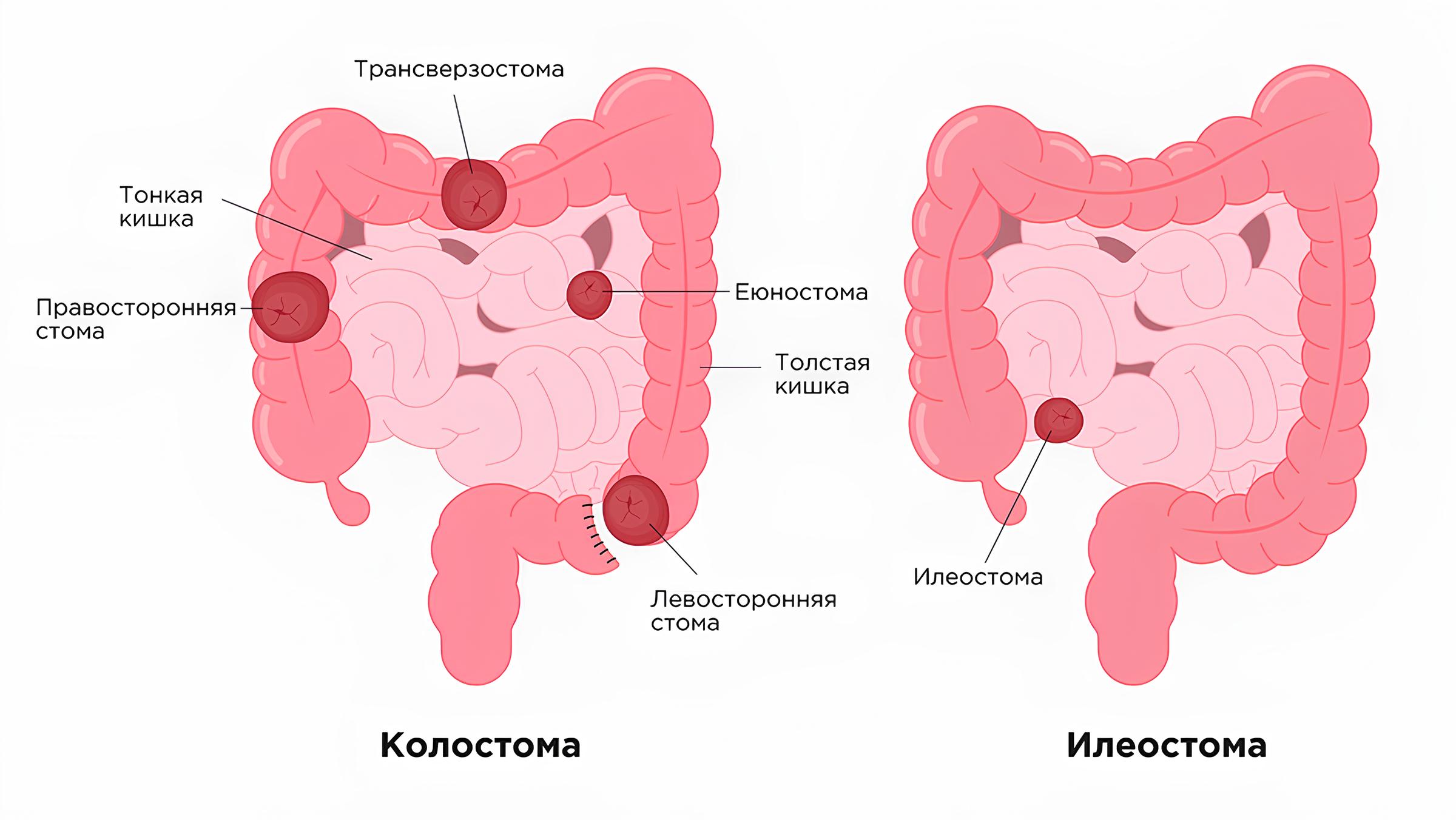
Рис. 1. Схематичное изображение кишечника и расположение стом
Представленный на рис. 2 илеоцекальный отдел толстой кишки –– многофункционален. Он, в частности, регулирует моторную деятельность кишечника. Клапан илеоцекального отдела –– баугиниева (Bauchini) заслонка –– снабжён циркулярными мышцами, поэтому ряд авторов считают его сфинктером [4]. Удаление илеоцекального клапана приводит к ретроградной миграции (транслокации) бактериальной флоры толстого кишечника, чрезмерному увеличению её количества [5].
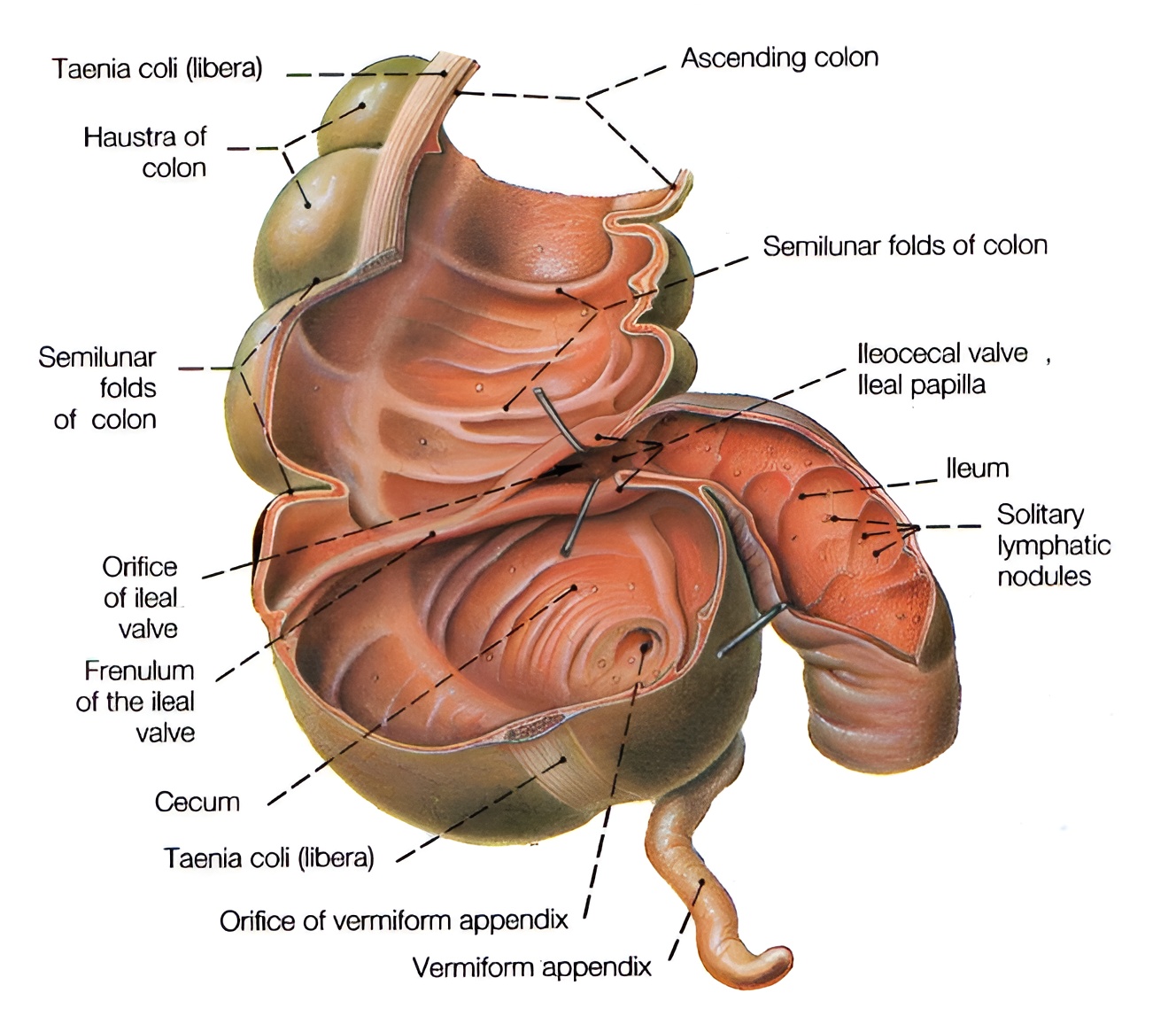
Рис. 2. Слепая кишка с илеоцекальным отверстием, имеющим заслонку
Резекция толстой кишки вызывает ускоренный пассаж содержимого по кишечнику, потерю жидкости и электролитов, обезвоживание.
Одна из сложных проблем –– тактика лечения новорождённых детей с тонкокишечными стомами. После резекции различных отделов тонкой кишки (двенадцатиперстной, тощей и/или подвздошной) нарушается всасывание основных пищевых нутриентов: белков, жиров, углеводов; а также всасывание жидкости и электролитов, желчных кислот [6]. При выведении еюностомы (из петли тощей кишки в верхней части тонкого кишечника) наблюдается особенно значительная потеря кишечного химуса, нередко превышающая пищевую нагрузку, что прогрессивно нарушает естественный процесс пищеварения и приводит к декомпенсации общего состояния [7].
Нутритивная поддержка пациентов после оперативного лечения как рекомендуется [8], включала сочетание парентерального и энтерального питания. Обязательными являются три этапа: первый –– полное парентеральное питание –– проводился при невозможности энтеральной нагрузки из–за нарушения моторики ЖКТ или в виду необходимости его «покоя», например, в раннем послеоперационном периоде. Второй этап –– частичное парентеральное питание с постепенным возобновлением энтерального. Третий этап –– переход, насколько это возможно, на энтеральное питание, что прежде всего зависит от длины сохранённого кишечника [9].
Расчёт потребности в нутриентах и парентеральное питание в нашей выборке проводились в соответствии с проектом клинического протокола «Парентеральное питание новорождённых» [10]. Детям назначалось дополнительное количество жидкости –– 10–12 мл/кг/сутки. Количество белка рассчитывалось, как и рекомендовано, по весу и гестационному возрасту (2,5–3,0 г/кг/сутки), с существенным увеличением (до 4–4,5 г/кг/сутки) у тяжёлобольных при сопутствующих кардиореспираторных проблемах, критических ситуациях и системной воспалительной реакции.
Введение энтерального питания –– сложный и ответственный момент послеоперационного выхаживания новорождённых со стомами. Для лучшей интестинальной адаптации необходимо стремиться к более раннему его началу с трофического питания, проводить непрерывно, контролировать эффективность вскармливания и сохранение толерантности к пищевой нагрузке. У наших пациентов восстановления пассажа по кишечнику и появление стула обычно приходилось на 3–4 день после операции. К этому времени удавалось стабилизировать гемодинамику, купировать дыхательные нарушения и послеоперационный парез кишечника. Парентеральное питание, как и рекомендуется [10, 11, 12], уменьшалось в зависимости от количества нутриентов и калоража, которые ребёнок мог ежедневно потреблять и усваивать энтерально, что прежде всего зависело от длины тонкой кишки, которая во время операции признана жизнеспособной и сохранена. Считается, что если функционирует илеоцекальный клапан и длина тонкой кишки не менее 25 см, или при отсутствии баугиниевой заслонки осталось 40–50 см тонкого кишечника, то у младенца есть шанс прекращения полного парентерального питания [13]. Даже в последнем случае, раннее начало трофического питания позволяет отказаться от полного парентерального питания у половины пациентов [14]. Начав с трофического питания с 1–5 мл/кг/сутки, количество предлагаемой пищи увеличивали по переносимости на 10–20 мл/кг/сутки до полного физиологического объёма. Как рекомендуется, контролировали продвижение кишечного содержимого и потери химуса, которые не должны превышать 30–40 мл/кг/сутки (происходят преимущественно через стому) [15]. Скорость «ухода» от парентерального питания в основном зависела от потерь по кишечной стоме, длины оставшейся тонкой кишки, процента суточной потребности в энергии и нутриентах, которое она сможет обеспечить. Обязательно проводили рекомендуемый мониторинг [15]. Контролировали диурез пациента, анализы мочи, а также показатели сыворотки крови: электролиты, общий белок, мочевину, общий билирубин и его фракции, ферменты холестаза (ГГТ, ЩФ) и цитолиза гепатоцитов (АЛТ, АСТ), коагулограмму, общий анализ крови, СРБ.
Безусловное преимущество в энтеральном питании следует отдавать грудному молоку [16]. Оно содержит не только полноценный состав пищевых нутриентов, но также иммунные факторы защиты младенца, эссенциальные длинноцепочечные жирные кислоты (в том числе противовоспалительные), среднецепочечные жирные кислоты с высокой энергетической ценностью и лёгкой усвояемостью, крайне важные факторы роста, которые стимулируют адаптацию и репарацию кишечника, а также многие другие не менее ценные составляющие [17, 18, 19]. Имеются данные о том, что использование грудного молока сокращает продолжительность парентерального питания за счёт ускоренной адаптации кишечника к энтеральной нагрузке [20,9].
В нашем исследовании грудное молоко в раннем послеоперационном периоде получали 56% младенцев (n=9). У остальных 44% (n=7), как и рекомендуется [9], использовались лечебные формулы с высоким гидролизом белка коровьего молока без лактозы, обогащённые среднецепочечными жирными кислотами. Известно отрицательное влияние энтеральной паузы, особенно длительной. Хотя до сих пор нет доказательных работ по оптимальной и максимально возможной продолжительности такой паузы, большинство авторов считает, что она не должна превышать 5–7 дней [21, 21]. Длительное отсутствие энтерального питания сопровождается снижением выработки энтеральных гормонов (холецистокинина, мотилина, гастрина и других), нарушением энтерогепатической циркуляции желчных кислот, что может приводить к холестазу и болезни печени, ассоциированной с кишечной недостаточностью (англ. Intestinal Failure Associated Liver Disease; IFALD) [22]. На рис. 3 представлены синтез и энтерогепатическая циркуляция желчных кислот, нарушающиеся при холестазе.
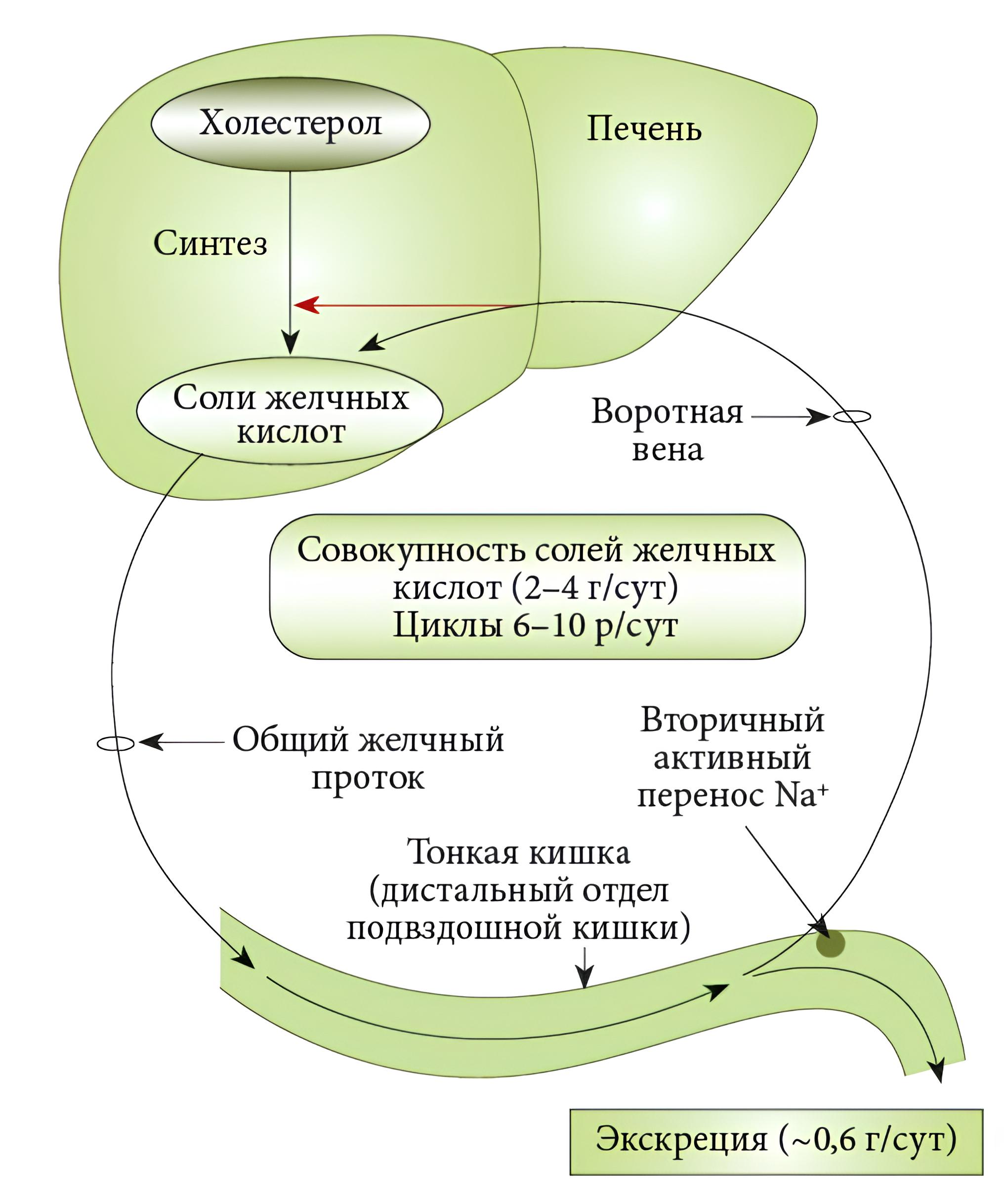
Рис. 3. Схема синтеза и энтерогепатической циркуляции желчных кислот, нарушающихся при холестазе
Синдром холестаза может быть установлен на основании повышения прямого билирубина более чем на 20% от уровня общего или более 17 мкмоль/л в сочетании с повышением активности щелочной фосфатазы (ЩФ), гамма–глутамилтрансферазы (ГГТ), холестерина и желчных кислот, а также снижения протромбинового индекса. Подтверждаем, что при длительном парентеральном питании уменьшает холестаз ограничение применения внутривенных жировых препаратов на основе соевых липидов [23]. При выявлении признаков холестаза до его разрешения, как и рекомендуется [11], наши пациенты получали пероральные препараты урсодезоксихолевой кислоты в дозе 20 мг/кг/сутки, разделённой на 2 приёма.
У 25% (n=4) новорождённых со стомами имел место клинический симптомокомплекс транслокации и избыточного роста бактериальной флоры, который проявлялся вздутием живота, напряжением брюшной стенки, нарушением пассажа по кишечнику (отсутствием перистальтики и отделяемого по стоме), рвотой с желчью; в лабораторных показателях крови увеличивались маркеры воспаления. В подобных случаях может запускаться каскад провоспалительных реакций, возникает конкуренция микроорганизмов за метаболиты, потребление энтеральных питательных веществ и витаминов, что ведёт к гипоксии тканей, деконъюгации желчных кислот, накоплению токсичных метаболитов, ухудшению репарации оперированного участка кишечника [5]. Стратегия профилактики избыточного бактериального роста включает использование антибиотиков и снижение потребления углеводов у пациентов с частичным энтеральным питанием. Для коррекции такого осложнения в послеоперационном периоде всем нашим пациентам проводилась антибактериальная терапия, у указанных 25% (n=4) курс деконтаминации кишечника повторялся.
Стомы у новорождённых практически всегда временные. Хотя вопрос о сроках и способах их закрытия, формирования анастомозов очень дискутабельный, через некоторое время (3–6 месяцев или существенно раньше) стому закроют и дефекация будет обычной [7, 24]. Несмотря на достаточно кратковременный период контакта кишечного содержимого с кожей живота, уход за стомами не простое дело. Даже у доношенных новорождённых роговой слой кожи очень тонкий (примерно на 30% тоньше, чем у взрослых), поэтому вокруг стомы с большой вероятностью могут появляться эрозии, мацерация кожи, перистомальный дерматит, бактериальное воспаление. Кожа может повреждаться также из-за аллергических реакций на компоненты калоприемников. По мнению большинства авторов, особенности ухода за стомами, специфика осложнений зависят от метода стомирования и, конечно, от отдела стомированного кишечника [7, 24]. В связи с этим важно объяснять родителям анатомические особенности стомы, обратить внимание на предикторы осложнений, требующие обращения за медицинской помощью, научить правильному уходу в домашних условиях [25]. Показано [26], что матери ухаживали за детьми в домашних условиях лучше, чем в условиях стационара. Необходимо индивидуально, своевременно подобрать средства и материалы для ухода за кожей вокруг стом. Используют специальные салфетки и мази, гели, защитные плёнкообразующие средства, например, защитную плёнку фирмы Coloplast, салфетки в индивидуальной упаковке Conveen и т.п. При использовании таких салфеток через минуту–две образуется защитный слой, эластичная плёнка, которую потом можно удалить водой. Используют также специальные очищающие и обезжиривающие средства по уходу, например, фирмы Coloplast или ConvaTec. Используют также барьерные пасты, преимущественно на основе оксида цинка. Фирмы производители («Колопласт» и «КонваТек») выпускают калоприемники, которые можно применять с периода новорождённости [25]. При пользовании калоприёмником для профилактики и лечения перистомальных осложнений полезны регулярные воздушные ванны. Не рекомендуются средства, которые могут нарушить барьерную функцию кожи и изменить её рН, такие как мыло, детские влажные салфетки, а также средства, содержащие спирт, масла и т. п.
Для демонстрации тактики ведения новорождённого с илеостомой приводим клинический случай пациента К.
Ребёнок от V беременности, которой предшествовали двое родов и 2 медаборта. В первом триместре беременности женщина перенесла ОРВИ с высокой температурой и антибиотикотерапией. На диспансерном учёте с 32 недель, выявлен гестационный сахарный диабет, многоводие. Роды при сроке 37 недель с преждевременным излитием светлых околоплодных вод. Безводный промежуток 6 часов. I период родов 2 часа 45 минут, II –– 10 минут. Апгар 9/9 баллов. Масса тела при рождении 3115 г, длина 50 см.
С рождения состояние расценивалось как удовлетворительное. Ухудшение наступило к концу первых суток жизни: гипервозбудимость, раздраженный монотонный крик, ранняя желтуха, сероватый оттенок кожи, акроцианоз. Живот был напряжён, печень увеличена, скудный стул получен только после клизмы. Ребёнок в возрасте 25 часов жизни в тяжёлом состоянии поступил в отделение реанимации новорождённых ОПЦ: начата ИВЛ, получал антибиотикотерапию, полное парентеральное питание.
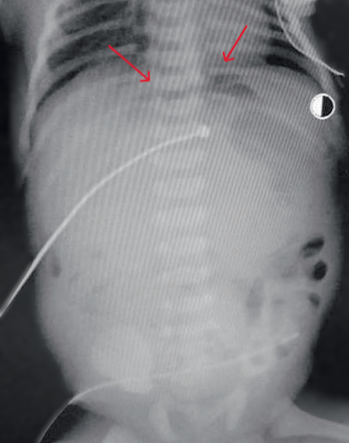
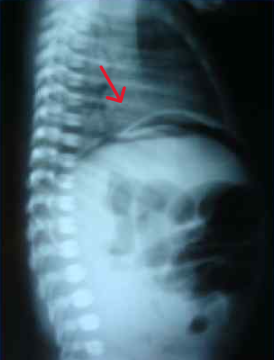
В возрасте 37 часов жизни с диагнозом кишечная непроходимость, перфорация полого органа для хирургической помощи перегоспитализирован в реанимационное отделение новорождённых ОДКБ в тяжёлом состоянии на ИВЛ. На рентгенограммах органов брюшной полости выявлен симптом «серпа», характерный для пневмоперитонеума (рис. 4).
|
|
Рис. 4. На рентгенограммах органов брюшной полости характерный признак пневмоперитонеума – симптом «серпа»
По экстренным показаниям выполнена лапаротомия. Во время ревизии брюшной полости обнаружено значительное количество мутного выпота с гноем, петли тонкой кишки раздуты, гиперемированы, багровые с налётами фибрина, отёчны, рыхлый спаечный процесс. В петлях значительное количество мекония, несколько участков терминального отдела подвздошной кишки с уплотнениями, один из них сужен (закрывшаяся антенатальная перфорация), видимой перфорации нет. Брюшная полость дренирована. Выведена илеостома.
Послеоперационный диагноз основного заболевания: инфекция специфичная для перинатального периода: внутриутробный перфоративный энтероколит, гнойный перитонит. Операция: лапаротомия, ревизия и дренирование брюшной полости, илеостомия.
В послеоперационном периоде состояние ребенка сохранялось тяжёлым. Были выражены клинические и параклинические признаки бактериальной инфекции, отмечались парез кишечника, нестабильность гемодинамики, геморрагический синдром с лёгочным кровотечением, вероятно, вызванный повреждением печени, ассоциированным с инфекцией и отсутствием энтерального питания. Получал ИВЛ, парентеральное питание, массивную антибактериальную терапию, кардиотоники, переливание СЗП, эритроцитарной взвеси. Стойкое улучшение состояния к 8–м суткам после операции: закончена респираторная поддержка, появилась перистальтика кишечника, по стоме стал отходить водянистый жёлто-зелёный стул. На следующие сутки начато энтеральное кормление в трофическом объёме (1–5 мл/кг/сутки) с постепенным медленным расширением.
В возрасте 30 дней ребёнок, который со вторых суток жизни являлся носителем илеостомы, перенёс внутриутробный перфоративный энтероколит и гнойный перитонит, имел недостаточность питания на фоне синдрома короткой кишки. Проведена операция релапаротомии: ревизия брюшной полости, резекция илеоцекального угла (в операционном биопсийном материале гранулематозный колит с перфорацией), формирование илеоколоанастамоза и илеоилеоанастамоза.
Клинический случай показывает, что у новорождённого отключение большой части подвздошной кишки, поражённой врождённой инфекцией, и наложение илеостомы в первые два дня жизни было жизнеспасающей операцией. Несмотря на тяжёлое течение основного заболевания (внутриутробного перфоративного энтероколита и гнойного перитонита), необходимость борьбы с инфекцией, типичными нехирургическими осложнениями, интенсивная послеоперационная терапия в отделении реанимации новорождённых, парентеральное и относительно раннее энтеральное питание, в том числе грудным молоком, адекватное выхаживание позволили уже через месяц перейти к реконструктивному этапу лечения.
Заключение
Актуальной и сложной проблемой неонатологии является стомирование кишечника, особенно тонкого, у новорождённых детей при тяжёлых заболеваниях и пороках развития желудочно-кишечного тракта. Для хирурга неоднозначен вопрос выбора способа и уровня формирования стомы, времени её закрытия. После операции не менее острая проблема –– профилактика ассоциированных осложнений. Чаще это нехирургические осложнения (большие энтеральные потери по стоме, электролитные нарушение, синдром мальабсорбции, холестаз, избыточный бактериальный рост кишечной микрофлоры), которые снижают репаративные возможности кишечника, способствуют формированию хронической кишечной и печёночной недостаточности.
Очень важна адекватная реанимационная помощь новорождённому с интенсивной стабилизацией состояния, полноценным мониторингом, коррекцией гомеостаза, контролем инфекции. Необходимо, наряду с парентеральным, по возможности рано начать трофическое энтеральное питание, расширять его по переносимости сохранённым кишечником. Особенно важно иметь при этом грудное молоко и материнское участие в уходе за младенцем и стомой.
Профилактика и своевременная коррекция сопутствующих стомированию осложнений –– приоритетная задача выхаживания и подготовки ребёнка к заключительному реконструктивному этапу лечения.
Список литературы
1. Иванов С.Д., Слизовский Г.В., Балаганский Д.А., и соавт. Результаты хирургического лечения новорождённых детей с кишечными стомами в условиях областного перинатального центра. Детская хирургия. 2021; 25(3): 158-164. doi: 10.18821/1560-9510-2021-25-3-158-164.
2. Минаев С.В., Быков Н.И., Исаева А.В. и соавт. Осложнения кишечных стом у детей. Хирургия. Журнал им. Н.И. Пирогова. 2017;(1):54-57. doi: 10.17116/hirurgia2017154-57.
3. Наумова Н.А., Леонтьева Е.А. Нюансы ведения пациентов с воспалительными заболеваниями кишечника. Первый медицинский телеканал. Лекция. 2023.
4. Валькер Ф.И. Развитие органов у человека после рождения. Л.: Медгиз, 1951. 190 с.
5. Korpela K, Mutanen A, Salonen A, Savilahti E, de Vos WM, Pakarinen MP. Intestinal Microbiota Signatures Associated With Histological Liver Steatosis in Pediatric-Onset Intestinal Failure. JPEN J Parenter Enteral Nutr. 2017 Feb;41(2):238-248. doi: 10.1177/0148607115584388.
6. Аверьянова Ю.В., Батыршин И.М., Демко А.Е. и соавт. Клинические рекомендации Северо-Западной ассоциации парентерального и энтерального питания, Межрегиональной ассоциации по неотложной хирургии, Российской гастроэнтерологической ассоциации, Союза реабилитологов России и Российского трансплантационного общества по диагностике и лечению синдрома короткой кишки с кишечной недостаточностью у взрослых. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022;32(1):60–103. doi: 10.22416/1382-4376-2022-32-1-60-103.
7. Иванов С.Д., Слизовский Г.В., Шикунова Я.В. Актуальные вопросы хирургического лечения новорождённых детей с тонкокишечными стомами. Российский вестник перинатологии и педиатрии. 2022;67(1):21-27. doi: 10.21508/1027-4065-2022-67-1-21-27
8. Ерпулёва Ю.В., Чубарова А.И., Чугунова О.Л. Парентеральное и энтеральное питание детей : практические рекомендации. М.: ГЭОТАР-Медиа, 2016.
9. Чубарова А.И. Лечебное энтеральное и парентеральное питание новорождённых. Национальное руководство – М.: Геотар-Медиа, 2014. – С. 653-692.
10. Грошева Е.В., Дегтярев Д.Н., Ионов О.В. и соавт. Проект клинического протокола "Парентеральное питание новорождённых". Неонатология: новости, мнения, обучение. 2013;2:89-97.
11. Нью Д. Гастроэнтерология и питание. Проблемы и противоречия в неонатологии; под ред. Р. Полина: пер. с англ. под ред. Ю.Г. Мухиной. – М., Логосфера, 2014.
12. Belza C, Fitzgerald K, de Silva N, Avitzur Y, Steinberg K, Courtney-Martin G, Wales PW. Predicting Intestinal Adaptation in Pediatric Intestinal Failure: A Retrospective Cohort Study. Ann Surg. 2019 May;269(5):988-993. doi: 10.1097/SLA.0000000000002602.
13. Исаков Ю.Ф., Володин Н.Н., Гераськин А.В. Неонатальная хирургия. – М., Династия, 2011. – 680 с.
14. Аверьянова Ю.В., Вессель Л., Ерпулева Ю.В. и соавт. Федеральные клинические рекомендации «Лечение детей с синдромом короткой кишки». Российский вестник детской хирургии, анестезиологии и реаниматологии. 2014;4:92-108.
15. Ерпулева Ю.В., Чубарова А.И. Современное ведение детей с синдромом короткой кишки и другими формами хронической кишечной недостаточности. Пособие для врачей. М., Геотар-Медиа, 2016. – 150.
16. Чубарова А.И. Алгоритм выбора энтерального питания новорождённых детей с хирургическими заболеваниями кишечника. Мат.V съезда Научного Общества Гастроэнтерологов России и XXXII сессии Центрального Научно- Исследовательского Института Гастроэнтерологии. – М., 2005. – С. 507.
17. Скворцова В.А., Боровик Т.Э., Нетребенко О.К. и соавт. Роль грудного молока в питании и выхаживании недоношенного ребенка. Педиатрия. Журнал им. Г. Н. Сперанского. 2015;5.
18. Patel AL, Johnson TJ, Engstrom JL, et al. Impact of early human milk on sepsis and health-care costs in very low birth weight infants. J Perinatol. 2013 Jul;33(7):514-9. doi: 10.1038/jp.2013.2.
19. Ben XM, Li J, Feng ZT, Shi SY, Lu YD, Chen R, Zhou XY. Low level of galacto-oligosaccharide in infant formula stimulates growth of intestinal Bifidobacteria and Lactobacilli. World J Gastroenterol. 2008 Nov 14;14(42):6564-8. doi: 10.3748/wjg.14.6564.
20. Ou J, Courtney CM, Steinberger AE, Tecos ME, Warner BW. Nutrition in Necrotizing Enterocolitis and Following Intestinal Resection. Nutrients. 2020 Feb 18;12(2):520. doi: 10.3390/nu12020520.
21. Грошева Е.В., Зубков В.В. Менеджмент энтерального питания недоношенных новорождённых, перенесших некротизирующий энтероколит, как основа благоприятных краткосрочных и долгосрочных исходов. Неонатология: новости, мнения, обучение. 2021;9(2):33-39.
22. Bishay M, Pichler J, Horn V, Macdonald S, Ellmer M, Eaton S, Hill S, Pierro A. Intestinal failure-associated liver disease in surgical infants requiring long-term parenteral nutrition. J Pediatr Surg. 2012 Feb;47(2):359-62. doi: 10.1016/j.jpedsurg.2011.11.032.
23. Ерпулева Ю.В., Чубарова А.И., Вайнштейн Н.П. и соавт. Осложнения длительного парентерального питания новорождённых и детей грудного возраста. Российский вестник детской хирургии, анестезологии и реаниматологии. 2017:7(1):59-69.
24. Ионов А. Л., Щербакова О. В., Сулавко Я. П. и др. Перистомальные осложнения и принципы ухода за кишечной стомой у детей. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2011;4:3-11.
25. Логунова Ю. Как дальше быть, или Краткое пособие по уходу за стомами в помощь родителям особенных малышей и младшему и среднему медицинскому персоналу. – М.: Р. Валент, 2014 —124.
26. Melville CA, Bisset WM, Long S, Milla PJ. Counting the cost: hospital versus home central venous catheter survival. J Hosp Infect. 1997 Mar;35(3):197-205. doi: 10.1016/s0195-6701(97)90207-3.
Об авторах
Е. А. КуприяноваРоссия
Екатерина Андреевна Куприянова, врач-педиатр, ординатор-неонатолог
ИНПО; кафедра педиатрии
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье
Я. С. Мирзоева
Россия
Яна Сергеевна Мирзоева, врач-терапевт, ординатор-неонатолог
ИНПО; кафедра педиатрии
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье
Н. Ю. Силуянова
Россия
Наталья Юрьевна Силуянова, ассистент, зав. отделения, главный внештатный специалист по неонатологии Минздрава Ярославской области
ИНПО; кафедра педиатрии; кафедра фтизиатрии; ОРИТ ОПННД
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье
Л. Е. Строева
Россия
Лариса Емельяновна Строева, к. м. н., доцент
ИНПО; кафедра педиатрии
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье
Рецензия
Для цитирования:
Куприянова Е.А., Мирзоева Я.С., Силуянова Н.Ю., Строева Л.Е. Особенности ведения детей с кишечными стомами разной локализации в неонатальном периоде. Пациентоориентированная медицина и фармация. 2025;3(3):40-49. https://doi.org/10.37489/2949-1924-0101. EDN: MBYUNI
For citation:
Kupriyanova E.A., Mirzoeva Ya.S., Siluyanova N.Yu., Stroeva L.E. Peculiarities of management of children with intestinal stomas of different localization in the neonatal period. Patient-Oriented Medicine and Pharmacy. 2025;3(3):40-49. (In Russ.) https://doi.org/10.37489/2949-1924-0101. EDN: MBYUNI
JATS XML


































.png)
