Перейти к:
Эффективность нутритивной поддержки и её роль в процессе лечения лиц с саркопенией
https://doi.org/10.37489/2949-1924-0003
Аннотация
Цель текущего описательного обзора — выявить роль питания в профилактике и лечении саркопении у пожилых людей. Большинство публикаций, которые были включены в этот обзор, показывают, что потребление белка и витамина D, а также здоровое и сбалансированное питание играют важную протективную роль против развития саркопении. Однако современных научных данных недостаточно для того, чтобы сделать обоснованные выводы. Хотя роль питания при саркопении в значительной степени оценивалась по научным публикациям за последние 10 лет, всё-таки большинство проведённых исследований отличаются высокой гетерогенностью и небольшими размерами выборки. Необходимы более масштабные метаанализы и рандомизированные исследования со строгими критериями включения, для более точного описания роли питания в развитии и лечении саркопении. Был проведён поиск литературы в трёх электронных базах данных: PubMed, Cochrane Library, Scopus — за период c 2012 по 1 декабря 2022 года. Вторичные источники включали статьи, цитируемые в статьях, извлечённых из вышеупомянутых источников. Критериями включения были перекрёстные или когортные исследования с участием лиц в возрасте ≥60 лет. Ограничений на языковой уклон публикации введено не было. Стратегия поиска: ключевыми словами, использованными для описания состояния участников, были: «пожилой возраст», «немощность», «саркопения».
Ключевые слова
Для цитирования:
Плещёв И.Е., Николенко В.Н., Ачкасов Е.Е., Шкребко А.Н., Плещёва Т.Н., Бирг А.Б., Синьлян Ч., Греков Д.А. Эффективность нутритивной поддержки и её роль в процессе лечения лиц с саркопенией. Пациентоориентированная медицина и фармация. 2023;1(1):12-22. https://doi.org/10.37489/2949-1924-0003
For citation:
Pleshchev I.E., Nikolenko V.N., Achkasov E.E., Shkrebko A.N., Pleshchevа T.N., Birg A.B., Xinliang Z., Grekov D.A. The efficacy of nutritional support and its role in the treatment of persons with sarcopenia. Patient-Oriented Medicine and Pharmacy. 2023;1(1):12-22. (In Russ.) https://doi.org/10.37489/2949-1924-0003
Введение
В последнее время саркопения у пожилых людей стала важной проблемой здравоохранения. Сообщалось, что слабость скелетных мышц, вызванная саркопенией, увеличивает смертность [1] и снижает качество жизни [2][3]. По этой причине в 2016 году Всемирная организация здравоохранения (ВОЗ) официально определила саркопению как заболевание пожилых людей [4].
Саркопения является распространённым клиническим заболеванием среди людей пожилого возраста. Это синдром, характеризующийся прогрессирующей и генерализованной потерей массы скелетных мышц, силы и мышечной функции [5]. Саркопения связана со слабостью, потерей независимости, инвалидностью, повышенным риском падений и снижением качества жизни [6][7]. Значительное клиническое воздействие саркопении и высокие затраты на её лечение подчёркивают необходимость сосредоточения системы здравоохранения на этом гериатрическом синдроме [8][9].
Распространённость саркопении широко варьируется в зависимости от региона и страны проживания, методов и критериев оценки (биоимпедансометрия, МРТ, КТ, ДРА, калиперометрия) [5][10], а также уровня финансирования конкретным государством программ, направленных на профилактику и лечение заболеваний у людей пожилого и старческого возраста [11]. В частности, число людей с саркопенией в Бразилии составляет 4,5 % [12], Турции 5,2 % [13], Китае 10 % (мужчин 12,3 %; женщин 7,6 %), Российской Федерации до 22,1 % [9][14].
В настоящее время выявлено множество факторов, влияющих на риск развития саркопении [13][14], и недостаточное питание (мальнутриция) совместно с дефицитом витамина D [15] являются важными триггерами в механизме её развития, наравне с отсутствием физических нагрузок, гормональными изменениями, в том числе возрастными, сопутствующими заболеваниями (атеросклероз, ожирение и т. д.) и нейродегенеративными процессами в мышечной ткани (см. рис.).
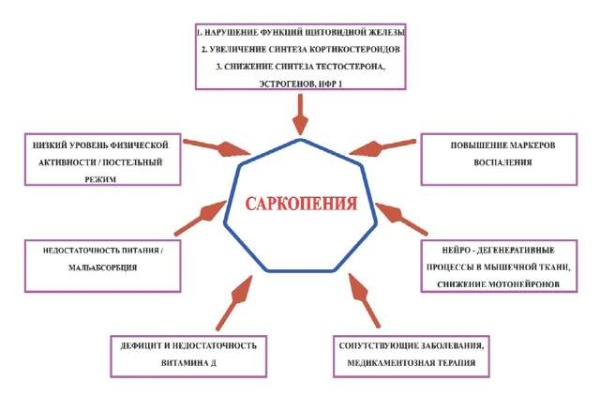
Рис. Патогенез саркопении
Figure. Pathogenesis of sarcopenia
Широкие различия в скорости и качестве старения являются результатом взаимодействий между различными генетическими / эпигенетическими факторами, а также факторами окружающей среды и образа жизни, которые влияют на наш организм на протяжении всей жизни. Питание рассматривается как один из наиболее важных изменяемых предикторов образа жизни, влияющих на весь процесс старения, и всё больше данных указывает на то, что питание является основным фактором риска возникновения хронических заболеваний [16]. Многие изменения, сопровождающие старение, такие как анорексия старения, изменения состава тела, ухудшение здоровья полости рта и снижение сенсорных функций, а также патологические и социально-экологические факторы могут способствовать плохому уровню питания из-за недостаточного потребления питательных веществ [17]. Недоедание представляет собой распространённую проблему среди пожилых людей, данные показывают, что до 22 % пожилых людей недоедают и более 45 % подвержены риску недоедания [18]. Последствия недоедания разнообразны, серьёзны и длительны. Люди с плохим состоянием питания испытывают ускоренный переход от уязвимости к хрупкости и зависимости, а также подвергаются повышенному риску смертности [6][17].
Сильно зависят от состояния питания и скелетные мышцы, которые являются крупнейшим метаболическим органом в организме. Это ключевое место для поглощения и хранения глюкозы и крупнейший резервуар белков и свободных аминокислот в организме, играющий ключевую роль в глобальном метаболическом гомеостазе [19]. Действительно, недоедание вместе с факторами, связанными с возрастом, такими как хроническое воспаление, окислительный стресс и гормональные изменения, является ключевым фактором развития саркопении [6][11]. Согласно текущим оценкам, 5-10 % пожилых людей в возрасте 60-70 лет и 11-50 % тех, кто старше 80 лет, сталкиваются с этой проблемой [20]. Таким образом, эти статистические данные указывают на то, что этот вопрос вызывает серьёзную озабоченность общественного здравоохранения.
Пищевые белки стимулируют синтез белка в скелетных мышцах и ингибируют распад мышечного белка [15]. Некоторые исследования показали связь между потреблением белка и мышечной массой и силой [21][22]. Влияние белковых добавок было особенно очевидно на мышечную силу и функцию [23], а не на массу. Однако одних белтяжёлого катаболизма. Пожилые люди часто не достигают рекомендуемой нормы потребления белков и калорий в рационе. Прежде всего, с возрастом наблюдается снижение аппетита, так называемая анорексия старения [24]. Кроме того, пищевые привычки меняются из-за проблем с глотанием и / или экономических проблем.
Таким образом, потребление богатых белками питательных веществ переключается в пользу продуктов, разбавленных энергией (злаки, овощи и фрукты) [25].
Ежедневная потребность в белке
На протяжении многих лет было установлено, что недостаточное потребление белка с пищей связано с потерей мышечной массы у пожилых людей из-за снижения синтеза мышечного белка в организме [26].
В 2013 и 2014 годах два консенсусных исследования Европейского общества клинического питания и обмена веществ (англ. European Society for Clinical Nutrition and Metabolism; ESPEN) и Международной исследовательской группы для изучения потребностей в белках с пищей в связи со старением (англ. PRevention in Older people — Assessment in GEneralists» practices; PROT-AGE study group) [27][28] показали, что традиционная суточная норма белков для взрослых всех возрастов (0,8 г / кг массы тела в день) недостаточна для пожилых людей. Людям в возрасте 65 лет и старше требуется больше белков для активации синтеза мышечного белка, по сравнению с молодыми людьми [28]. Фактически пожилым людям приходится противодействовать анаболической резистентности, подкреплённой повышенной секвестрацией аминокислот в кишечнике, снижением перфузии мышц после приёма пищи, снижением усвоения мышцами пищевых аминокислот, снижением анаболической сигнализации для синтеза белка и нарушением пищеварительной способности [29]. Более того, им требуется больше белков, чтобы компенсировать воспалительные и катаболические состояния, связанные с хроническими и острыми заболеваниями [27]. Таким образом, как группа ESPEN, так и группа PROT-AGE согласны с предположением о 1-1,2 г белков на кг массы тела в день. Диета с высоким содержанием белка не повреждает почки у здоровых пожилых людей, в то время как люди с тяжёлым заболеванием почек, которые не проходят диализ, должны ограничить потребление белка примерно на 0,8 г / кг массы тела в день [28]. Источник белка и аминокислотный состав также важны: растительные белки обладают меньшим анаболическим эффектом по сравнению с животными белками [30], вероятно, потому, что в них меньше лейцина. Более того, независимо от содержания аминокислот, белки могут иметь различную кинетику всасывания, что может влиять на их анаболический эффект.
Распределённые схемы питания, при которых равное количество белка поступает в организм при каждом приёме пищи, по-видимому, оптимизируют способность к синтезу белка [31]. Тем не менее некоторые исследования также показали, что при импульсном питании (основные блюда с высоким содержанием белка) могут быть достигнуты анаболические преимущества [32]. Таким образом, необходимы дополнительные исследования для установления оптимального времени введения белка.
Существует также общее опасение, что выработка мышечной массы после белковой нагрузки может быть снижена у пожилых людей, что приводит к тому, что общее рекомендуемое потребление белка для пожилых людей должно быть увеличено. Данные наблюдений показывают сильную корреляцию между потреблением белка и мышечной массой [33]. При старении, воспалении и болезнях необходима более высокая доза белка для максимального синтеза мышечного белка. Оптимальной считается доза 1-1,2 г / кг массы тела в сутки [34]. Однако литература предполагает, что потребление белка в количествах, превышающих рекомендуемую суточную норму, может улучшить мышечную силу и массу у пожилых людей [35]. Один из аргументов, часто приводимых против фактических рекомендаций, основанных исключительно на балансе азота, заключается в том, что они не учитывают других параметров здоровья, таких как функция мышц. Принимая во внимание этот фактор, были использованы новые методы для переоценки рекомендаций по белку для пожилых людей. С этой целью были проведены некоторые исследования с использованием индикаторного окисления аминокислот (IAAO) в качестве нового подхода к определению потребностей в белке [36]. Исследования с применением этих методов указывают на большую потребность в белке у пожилых людей. Например, Rafii M et al. (2015 г.) [36] набрали женщин в возрасте 65 лет и старше и отметили повышенную потребность в белке на 1,29 г / кг / день. Аналогичным образом, при оценке пожилых мужчин исследователи обнаружили потребность в 1,24 г / кг / сут [36]. Rogeri PS et al. [26] в своих практических рекомендациях пришли к выводам, что для людей пожилого возраста общее ежедневное потребление белка должно составлять 1,6-1,8 г / кг / день.
Пищевые добавки при саркопении
Потребление пищи снижается примерно на 25 % с 40-70 лет, и даже в большей степени в сочетании с рационом питания, который можно охарактеризовать как однообразный, это может привести к недостаточному потреблению питательных веществ. При саркопении четыре области считались важными с точки зрения диеты: витамин D, аминокислоты, кальций и антиоксиданты [37].
Хотя диета играет важную роль во время лечения саркопении, диетические вмешательства изучены не так хорошо, по сравнению с большой доказательной базой силовых тренировок. Ясно одно, питание и физические нагрузки, подобранные с учётом индивидуальных особенностей человека, являются важным и взаимодополняющим тандемом в лечении и профилактики саркопении [5][38]. Как показано в табл. 1, существует большое количество доказательств того, что многие аспекты питания могут быть важны для контроля развития саркопении [12][17].
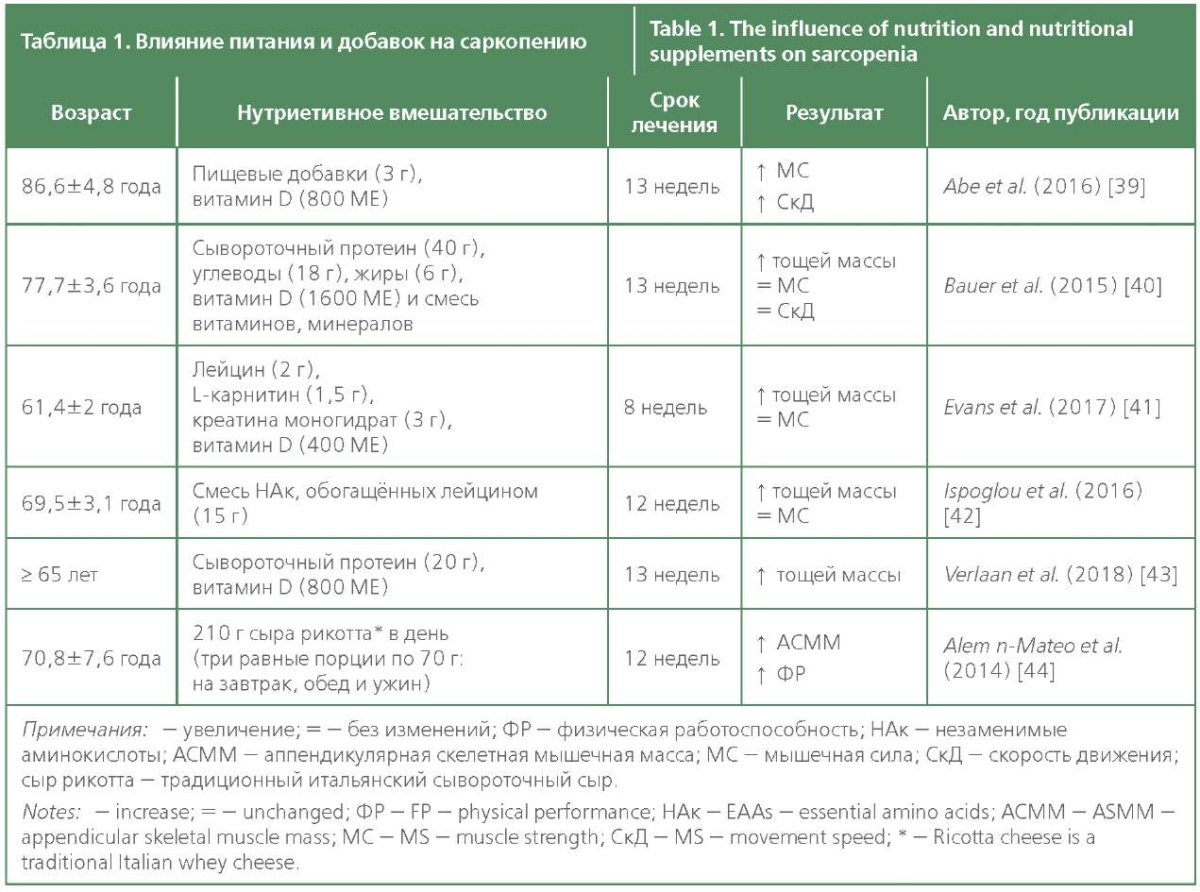
Белок обеспечивает организм аминокислотами, необходимыми для синтеза мышц. Незаменимые аминокислоты (НАк), в частности лейцин, также являются важным анаболическим стимулом [45]. Основными пищевыми источниками НАк являются нежирное мясо, молочные продукты, соевые бобы, горох и чечевица. Биологическими путями, на которые действует лейцин, являются активация рапамицина-мишени млекопитающих (mTOR) и ингибирование протеасомы. Однако для преодоления анаболической резистентности у пожилых людей необходим приём высоких доз НАк (10-15 г) и лейцина (не менее 3 г) [15][45]. Недавний метаанализ подтвердил, что лейцин способен увеличивать синтез мышечного белка у пожилых людей, и было обнаружено, что его потребление напрямую коррелирует с сохранением мышечной массы у здоровых пожилых людей. Более того, добавки с НАк у пожилых людей были эффективны как в увеличении мышечной массы, так и в функционировании [46].
Существуют также доказательства того, что аминокислота лейцин может активировать сигнальные пути, ведущие к синтезу белка. Что касается лейцина, результаты, полученные у пожилых людей, показывают, что в смеси незаменимых аминокислот требовалась высокая доля лейцина, чтобы обратить вспять неоптимальный синтез мышечного белка [47].
На самом деле, у пожилых мужчин одновременный приём 2,5 г кристаллического лейцина с чистым диетическим белком может усилить анаболический ответ. У здоровых пожилых людей добавление гидроксиметилбутирата (от англ. betahydroxy beta-methylbutyric acid; HMB) — это органическая кислота, которая образуется в организме человека вследствие расщепления аминокислоты лейцина, метаболита лейцина, — в течение 10 дней постельного режима может сохранить мышечную массу [48]. Однако исследование с участием пожилых мужчин (средний возраст 71 год) не показало влияния на силу или мышечную массу, что может быть связано с недостаточным количеством лейцина в рационе участников [47].
В проспективных исследованиях дефицит витамина D был связан со снижением мышечной массы и силы [49]. У большинства пожилых людей уровень витамина D в сыворотке крови ниже нормы.
Этиология этого дефицита многофакторна: недостаточное потребление пищи, недостаточное воздействие солнечных лучей, изменённая синтезирующая способность кожи и снижение конверсии почек в активную форму. Более того, с возрастом наблюдается снижение экспрессии рецепторов витамина D в мышечной ткани [50].
Добавки витамина D могут модулировать экспрессию рецепторов витамина D (VDR) [51] с положительным эффектом на производительность мышц и силу. Более того, это также улучшает состав мышечных волокон и морфологию [52]. Любопытно, что польза, по-видимому, заметна только у людей с низким уровнем витамина D.
Поэтому рекомендуется дозировать витамин D всем пациентам с саркопенией и назначать добавки тем, у кого его дефицит. Вместо этого всем пожилым людям следует рекомендовать достаточное пребывание на солнце вместе с потреблением продуктов, богатых витамином D (лосось, макрель, сельдь, вяленые грибы) [15].
Карнитин (β-гидрокси-γ-N-триметиламиномасляная кислота) — производное аминокислоты, участвующее в производстве энергии митохондриями в скелетных и сердечных мышцах. Карнитин в основном получают из пищевых источников, но он также синтезируется из лизина и метионина в печени, почках и головном мозге. В метаболическом пути карнитина в мышцах, свободный L-карнитин и ацилкарнитин вырабатывают энергию за счёт β-окисления жирных кислот [53]. Было обнаружено, что повышение уровней определённых типов ацилкарнитина приводит и может быть связано с нарушением регуляции метаболизма жирных кислот. Сообщалось, что дисфункция метаболических путей в митохондриях способствует уменьшению мышечной массы и потере мышечной силы [54]. Кроме того, недавние исследования показали, что определённые типы карнитина в крови обнаруживаются в недостаточном количестве у пациентов с саркопенией и значительно коррелируют с индексом скелетных мышц. Эти результаты указывают на то, что карнитин является потенциальным биомаркёром саркопении [53].
Сообщалось, что голодание и агрессивные гипокалорийные диеты наносят вред мышечной массе и функционированию, особенно когда потребности в белке не достигаются [55]. Это может быть связано с ингибированием пути mTORC1, как было продемонстрировано после нескольких недель низкоуглеводных диет с высоким содержанием жиров (англ. low-carbohydrate high-fat; LCHF) [56]. Несмотря на то что крайняя нехватка питательных веществ и энергии вызывает аутофагию, умеренное ограничение углеводов может оказать благоприятное влияние на исходы саркопении. По мнению Jiao J et al. (2017 г.), ограничение калорийности питания может увеличить продолжительность жизни и принести пользу для здоровья, и, следовательно, прерывистое и периодизированное ограничение калорийности (например, чередование дней голодания или прерывистое голодание) может быть подходящим в качестве стратегии противодействия саркопении [57]. С их выводами согласен и Webster BR et al. из центра молекулярной медицины США [58].
С точки зрения питания, как количество / качество белка, так и использование некоторых пищевых добавок (например, HMB и моногидрат креатина) можно рассматривать как наиболее важные факторы для противодействия саркопении. Если ожирение и саркопения возникают одновременно, диета с высоким содержанием белка плюс физические упражнения (особенно силовые тренировки) являются эффективной стратегией для уменьшения потери костно-мышечной ткани и улучшения качества жизни. Существуют и другие факторы, требующие дальнейших исследований, такие как: влияние частоты приёмов пищи, промежутков между ними, которые поддерживают оптимальный протеостаз. Также большую роль играют противовоспалительная и антиоксидантная способность некоторых молекул (например, N-ацетилцистеин, омега-3 и витамин D), влияние низкокалорийных диет (например, кетогенная диета) и изменения в функциях митохондрий.
Следовательно, стратегии питания, направленные на задержку развития саркопении, должны быть ориентированы не только на стимуляцию синтеза белка и ингибирование его распада, но и на предоставление молекулярных инструментов для улучшения функции митохондрий и уменьшения воспаления, а также на поддержку здорового старения. Наконец, необходимо отметить, что как первичная, так и вторичная саркопения, вероятно, не должны иметь определённого протокола лечения, а должны управляться многопрофильной командой, координирующей действия медсестёр, врачей, диетологов и инструкторов по лечебной физической культуре в каждом конкретном случае [59].
Заключение
Патогенез саркопении многофакторен, и большинство из лежащих в основе факторов действуют сообща, оказывая влияние на риск заболевания, поскольку многие причинные пути могут перекрываться или взаимосвязываться. Важно отметить, что сложность патогенеза саркопении представляет собой проблему для её лечения. К сожалению, современная фармакологическая терапия пока недоступна. Однако диетические вмешательства оказывают важное благотворное влияние на параметры мышц у пожилых людей. Более того, пропаганда физических упражнений в соответствии с руководящими принципами ВОЗ — это ещё один эффективный метод, учитывающий благотворный синергизм диетических и физических вмешательств.
В заключение, людям с саркопенией рекомендуется принимать 1-1,2 г белков на кг массы тела в день с высоким содержанием НАк (10-15 г) и лейцина (не менее 3 г) предпочтительно через 2-3 ч после тренировки, чтобы максимизировать их анаболический эффект. Пожилые люди, страдающие дефицитом или подверженные высокому риску дефицита витамина D, креатинина и L-карнитина, должны быть интегрированы в систему лечения.
Персонализация диеты и программ физических упражнений в соответствии с потребностями пациентов является ключевым моментом для лечения саркопении. Более того, следует поощрять профилактические стратегии, направленные на максимизацию пика мышечной массы во взрослом возрасте и уменьшение снижения мышечной массы в пожилом возрасте, формируя подход к этому состоянию на протяжении всей жизни, чтобы мышечная функция сохранялась как можно дольше, что несомненно окажет положительное влияние на качество жизни и долголетие.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Участие авторов. Плещёв И. Е., Николенко В. Н. — концепция и дизайн исследования, ответственность за целостность всех частей статьи, редактирование; Ачкасов Е. Е. — написание текста, статистическая обработка данных, редактирование; Шкребко А. Н. — концепция и дизайн исследования, редактирование; Плещёва Т. Н. — ответственность за целостность всех частей статьи, редактирование; Бирг А. Б. — концепция и дизайн исследования; Синьлян Ч., Греков Д. А. — сбор и обработка материала.
Финансирование. Работа выполнялась без спонсорской поддержки.
ADDITIONAL INFORMATION
Conflict of interests. The authors declare no conflict of interest.
Authors' participation. Pleshchev IE, Nikolenko VN. — study concept and design, collection and processing of material, editing; Achkasov EE — writing the text, statistical data processing, editing; Shkrebko AN — study concept and design, editing; Pleshcheva TN — responsibility for the integrity of all parts of the article, editing; Birg AB — study concept and design; Sinlyan Z, Grekov DA — collection and processing of material.
Список литературы
1. Sobestiansky S, Michaelsson K, Cederholm T. Sarcopenia prevalence and associations with mortality and hospitalisation by various sarcopenia definitions in 85-89 year old community-dwelling men: a report from the ULSAM study. BMC Geriatr. 2019;19:318. doi: 10.1186/s12877-019-1338-1
2. Beaudart C, Locquet M, Reginster JY, Delandsheere L, Petermans J, Bruyere O. Quality of life in sarcopenia measured with the SarQoL®: impact of the use of different diagnosis definitions. Aging Clin Exp Res. 2018;30 (4):307-13. doi: 10.1007/s40520-017-0866-9
3. Park HM. Current Status of Sarcopenia in Korea: A Focus on Korean Geripausal Women. Ann Geriatr Med Res. 2018;22 (2):52-61. doi: 10.4235/agmr.2018.22.2.52
4. Vellas B, Fielding RA, Bens C, et al. Implications of ICD-10 for Sarcopenia Clinical Practice and Clinical Trials: Report by the International Conference on Frailty and Sarcopenia Research Task Force. J Frailty Aging. 2018;7 (1):2-9. doi: 10.14283/jfa.2017.30
5. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis [published correction appears in Age Ageing. 2019 Jul 1;48 (4):601]. Age Ageing. 2019;48 (1):16-31. doi: 10.1093/ageing/afy169
6. Iannone F, Montesanto A, Cione E, Crocco P, Caroleo MC, Dato S, Rose G, Passarino G. Expression Patterns of Muscle-Specific miR-133b and miR-206 Correlate with Nutritional Status and Sarcopenia. Nutrients, 2020:12 (2);297. https://doi.org/10.3390/nu12020297.
7. Плещёв И. Е., Николенко В. Н., Ачкасов Е. Е., Шкребко А. Н. Алгоритм применения индивидуально-группового протокола при комплексной реабилитации пациентов с саркопенией. Вестник «Биомедицина и Социология». 2022:24 (5);44-53. doi: 10.26787/nydha-2618-8783-2022-7-2-44-53
8. Chen LK, Woo J, Assantachai P, et al. Asian Working Group for Sarcopenia: 2019 Consensus Update on Sarcopenia Diagnosis and Treatment. J Am Med Dir Assoc. 2020;21 (3):300-307. e2. doi: 10.1016/j.jamda.2019.12.012
9. Бочарова К. А., Рукавишникова С. А., Осипов К. В., Шадрин К. А., Одегнал А. А. [и др.]. Саркопения в системе долговременного ухода. Современные проблемы здравоохранения и медицинской статистики. 2021;2:12-26. https://doi.org/10.24412/2312-2935-2021-2-12-26.
10. Плещёв И. Е., Ачкасов Е. Е., Николенко В. Н., Шкребко А. Н. Саркопения: современные подходы к диагностике и реабилитации. Современные проблемы науки и образования. 2022;1. URL: https://science-education.ru/ru/article/view-id=31443 (date of application: 30.04.2022). doi: 10.17513/spno.31443
11. Yedigaryan L, Gatti M, Marini V, Maraldi T, Sampaolesi M. Shared and Divergent Epigenetic Mechanisms in Cachexia and Sarcopenia. Cells. 2022;11 (15):2293. doi: 10.3390/cells11152293
12. Alexandre TDS, Duarte YAO, Santos JLF, Lebrao ML. Prevalence and associated factors of sarcopenia, dynapenia, and sarcodynapenia in community-dwelling elderly in Sao Paulo — SABE Study. [Prevalencia e fatores associados a sarcopenia, dinapenia e sarcodinapenia em idosos residentes no Municipio de Sao Paulo — Estudo SABE]. Rev Bras Epidemiol. 2019;21Suppl 02 (Suppl 02): e180009. doi: 10.1590/1980-549720180009.supl.2
13. Simsek H, Meseri R, Sahin S, et al. Prevalence of sarcopenia and related factors in community-dwelling elderly individuals. Saudi Med J. 2019;40 (6):568-74. doi: 10.15537/smj.2019.6.23917
14. Shafiee G, Keshtkar A, Soltani A, Ahadi Z, Larijani B, Heshmat R. Prevalence of sarcopenia in the world: a systematic review and meta-analysis of general population studies. J Diabetes Metab Disord. 2017;16:21. doi: 10.1186/s40200-017-0302-x
15. Damanti S, Azzolino D, Roncaglione C, Arosio B, Rossi P, Cesari M. Efficacy of Nutritional Interventions as Stand-Alone or Synergistic Treatments with Exercise for the Management of Sarcopenia. Nutrients. 2019;11 (9):1991. doi: 10.3390/nu11091991
16. Dato S, Bellizzi D, Rose G, Passarino G. The impact of nutrients on the aging rate: A complex interaction of demographic, environmental and genetic factors. Mech Ageing Dev. 2016;154:49-61. doi: 10.1016/j.mad.2016.02.005
17. Agarwal E, Miller M, Yaxley A, Isenring E. Malnutrition in the elderly: a narrative review. Maturitas. 2013;76 (4):296-302. doi: 10.1016/j.maturitas.2013.07.013
18. Rasheed S, Woods RT. Malnutrition and quality of life in older people: a systematic review and meta-analysis. Ageing Res Rev. 2013;12 (2):561-6. doi: 10.1016/j.arr.2012.11.003
19. Gielen E, Verschueren S, O»Neill TW, et al. Musculoskeletal frailty: a geriatric syndrome at the core of fracture occurrence in older age. Calcif Tissue Int. 2012;91 (3):161-77. doi: 10.1007/s00223-012-9622-5
20. Liguori I, Russo G, Aran L, et al. Sarcopenia: assessment of disease burden and strategies to improve outcomes. Clin Interv Aging. 2018;13:913-27. doi: 10.2147/CIA.S149232
21. Isanejad M, Mursu J, Sirola J, et al. Dietary protein intake is associated with better physical function and muscle strength among elderly women. Br J Nutr. 2016;115 (7):1281-91. doi: 10.1017/S000711451600012X
22. Landi F, Calvani R, Tosato M, et al. Animal-Derived Protein Consumption Is Associated with Muscle Mass and Strength in Community-Dwellers: Results from the Milan EXPO Survey. J Nutr Health Aging. 2017;21 (9):1050-6. doi: 10.1007/s12603-017-0974-4
23. Park Y, Choi JE, Hwang HS. Protein supplementation improves muscle mass and physical performance in undernourished prefrail and frail elderly subjects: a randomized, double-blind, placebo-controlled trial. Am J Clin Nutr. 2018;108 (5):1026-33. doi: 10.1093/ajcn/nqy214
24. Morley JE. Anorexia of aging: a true geriatric syndrome. J Nutr Health Aging. 2012;16 (5):422-5. doi: 10.1007/s12603-012-0061-9
25. Malafarina V, Uriz-Otano F, Gil-Guerrero L, Iniesta R. The anorexia of ageing: physiopathology, prevalence, associated comorbidity and mortality. A systematic review. Maturitas. 2013;74 (4):293-302. doi: 10.1016/j.maturitas.2013.01.016
26. Rogeri PS, Zanella R Jr, Martins GL, et al. Strategies to Prevent Sarcopenia in the Aging Process: Role of Protein Intake and Exercise. Nutrients. 2021;14 (1):52. doi: 10.3390/nu14010052
27. Deutz NE, Bauer JM, Barazzoni R, et al. Protein intake and exercise for optimal muscle function with aging: recommendations from the ESPEN Expert Group. Clin Nutr. 2014;33 (6):929-36. doi: 10.1016/j.clnu.2014.04.007
28. Bauer J, Biolo G, Cederholm T, et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. J Am Med Dir Assoc. 2013;14 (8):542-59. doi: 10.1016/j.jamda.2013.05.021
29. Burd NA, Gorissen SH, van Loon LJ. Anabolic resistance of muscle protein synthesis with aging. Exerc Sport Sci Rev. 2013;41 (3):169-73. doi: 10.1097/JES.0b013e318292f3d5
30. van Vliet S, Burd NA, van Loon LJ. The Skeletal Muscle Anabolic Response to Plant — versus Animal-Based Protein Consumption. J Nutr. 2015;145 (9):1981-91. doi: 10.3945/jn.114.204305
31. Burd NA, Yang Y, Moore DR, Tang JE, Tarnopolsky MA, Phillips SM. Greater stimulation of myofibrillar protein synthesis with ingestion of whey protein isolate v. micellar casein at rest and after resistance exercise in elderly men. Br J Nutr. 2012;108 (6):958-62. doi: 10.1017/S0007114511006271
32. Bouillanne O, Curis E, Hamon-Vilcot B, et al. Impact of protein pulse feeding on lean mass in malnourished and at-risk hospitalized elderly patients: a randomized controlled trial. Clin Nutr. 2013;32 (2):186-92. doi: 10.1016/j.clnu.2012.08.015
33. Bianchi L, Ferrucci L, Cherubini A, et al. The Predictive Value of the EWGSOP Definition of Sarcopenia: Results from the InCHIANTI Study. J Gerontol A Biol Sci Med Sci. 2016;71 (2):259-64. doi: 10.1093/gerona/glv129
34. Reidy PT, Rasmussen BB. Role of Ingested Amino Acids and Protein in the Promotion of Resistance Exercise-Induced Muscle Protein Anabolism. J Nutr. 2016;146 (2):155-83. doi: 10.3945/jn.114.203208
35. Baum JI, Wolfe RR. The Link between Dietary Protein Intake, Skeletal Muscle Function and Health in Older Adults. Healthcare (Basel). 2015;3 (3):529-43. Published 2015 Jul 9. doi: 10.3390/healthcare3030529
36. Rafii M, Chapman K, Elango R, et al. Dietary Protein Requirement of Men >65 Years Old Determined by the Indicator Amino Acid Oxidation Technique Is Higher than the Current Estimated Average Requirement. J Nutr. 2015;146 (4):681-7. doi: 10.3945/jn.115.225631
37. Papadopoulou SK. Sarcopenia: A Contemporary Health Problem among Older Adult Populations. Nutrients. 2020;12 (5):1293. doi: 10.3390/nu12051293
38. Pleshchev IE, Achkasov EE, Nikolenko VN, Shkrebko AN, Sankova MV. Elderly People Physiical Rehabilitation Personalization: a Prospective Comparative Study of 198 Patients with Sarcopenia. Bulletin of Rehabilitation Medicine. 2022;21 (6): 9-18. doi: 10.38025/2078-1962-2022-21-6-9-18
39. Abe S, Ezaki O, Suzuki M. Medium-Chain Triglycerides in Combination with Leucine and Vitamin D Increase Muscle Strength and Function in Frail Elderly Adults in a Randomized Controlled Trial. J Nutr. 2016;146 (5):1017-26. doi: 10.3945/jn.115.228965
40. Bauer JM, Verlaan S, Bautmans I, et al. Effects of a vitamin D and leucine-enriched whey protein nutritional supplement on measures of sarcopenia in older adults, the PROVIDE study: a randomized, double-blind, placebo-controlled trial. J Am Med Dir Assoc. 2015;16 (9):740-7. doi: 10.1016/j.jamda.2015.05.021
41. Evans M, Guthrie N, Pezzullo J, Sanli T, Fielding RA, Bellamine A. Efficacy of a novel formulation of L-Carnitine, creatine, and leucine on lean body mass and functional muscle strength in healthy older adults: a randomized, double-blind placebo-controlled study. Nutr Metab (Lond). 2017;14:7. doi:10.1186/s12986-016-0158-y
42. Ispoglou T, White H, Preston T, McElhone S, McKenna J, Hind K. Double-blind, placebo-controlled pilot trial of L-Leucine-enriched amino-acid mixtures on body composition and physical performance in men and women aged 65-75 years. Eur J Clin Nutr. 2016;70 (2):182-8. doi: 10.1038/ejcn.2015.91
43. Verlaan S, Maier AB, Bauer JM, et al. Sufficient levels of 25-hydroxyvitamin D and protein intake required to increase muscle mass in sarcopenic older adults — The PROVIDE study. Clin Nutr. 2018;37 (2):551-7. doi: 10.1016/j.clnu.2017.01.005
44. Aleman-Mateo H, Carreon VR, Macias L, Astiazaran-Garcia H, Gallegos-Aguilar AC, Enriquez JR. Nutrient-rich dairy proteins improve appendicular skeletal muscle mass and physical performance, and attenuate the loss of muscle strength in older men and women subjects: a single-blind randomized clinical trial. Clin Interv Aging. 2014;9:1517-25. doi: 10.2147/CIA.S67449
45. Anthony JC, Anthony TG, Kimball SR, Jefferson LS. Signaling pathways involved in translational control of protein synthesis in skeletal muscle by leucine. J Nutr. 2001;131 (3):856S — 860S. doi: 10.1093/jn/131.3.856S
46. Xu ZR, Tan ZJ, Zhang Q, Gui QF, Yang YM. The effectiveness of leucine on muscle protein synthesis, lean body mass and leg lean mass accretion in older people: a systematic review and meta-analysis. Br J Nutr. 2015;113 (1):25-34. doi: 10.1017/S0007114514002475
47. Zengin A, Jarjou LM, Prentice A, Cooper C, Ebeling PR, Ward KA. The prevalence of sarcopenia and relationships between muscle and bone in ageing West-African Gambian men and women. J Cachexia Sarcopenia Muscle. 2018;9 (5):920-8. doi: 10.1002/jcsm.12341
48. Deutz NE, Pereira SL, Hays NP, et al. Effect of β-hydroxy-β-methylbutyrate (HMB) on lean body mass during 10 days of bed rest in older adults. Clin Nutr. 2013;32 (5):704-12. doi: 10.1016/j.clnu.2013.02.011
49. Scott D, Ebeling PR, Sanders KM, Aitken D, Winzenberg T, Jones G. Vitamin d and physical activity status: associations with five-year changes in body composition and muscle function in community-dwelling older adults. J Clin Endocrinol Metab. 2015;100 (2):670-8. doi: 10.1210/jc.2014-3519
50. Ceglia L, da Silva Morais M, Park LK, et al. Multi-step immunofluorescent analysis of vitamin D receptor loci and myosin heavy chain isoforms in human skeletal muscle. J Mol Histol. 2010;41 (2-3):137-42. doi: 10.1007/s10735-010-9270-x
51. Pojednic RM, Ceglia L, Olsson K, et al. Effects of 1,25-dihydroxyvitamin D3 and vitamin D3 on the expression of the vitamin d receptor in human skeletal muscle cells. Calcif Tissue Int. 2015;96 (3):256-63. doi: 10.1007/s00223-014-9932-x
52. Beaudart C, Buckinx F, Rabenda V, et al. The effects of vitamin D on skeletal muscle strength, muscle mass, and muscle power: a systematic review and meta-analysis of randomized controlled trials. J Clin Endocrinol Metab. 2014;99 (11):4336-45. doi: 10.1210/jc.2014-1742
53. Takagi A, Hawke P, Tokuda S, et al. Serum carnitine as a biomarker of sarcopenia and nutritional status in preoperative gastrointestinal cancer patients. J Cachexia Sarcopenia Muscle. 2022;13 (1):287-95. doi: 10.1002/jcsm.12906
54. Ruiz M, Labarthe F, Fortier A, et al. Circulating acylcarnitine profile in human heart failure: a surrogate of fatty acid metabolic dysregulation in mitochondria and beyond. Am J Physiol Heart Circ Physiol. 2017;313 (4):H768 — H781. doi: 10.1152/ajpheart.00820.2016
55. Hector AJ, McGlory C, Damas F, Mazara N, Baker SK, Phillips SM. Pronounced energy restriction with elevated protein intake results in no change in proteolysis and reductions in skeletal muscle protein synthesis that are mitigated by resistance exercise. FASEB J. 2018;32 (1):265-75. doi: 10.1096/fj.201700158RR
56. Ferretti R, Moura EG, Dos Santos VC, et al. High-fat diet suppresses the positive effect of creatine supplementation on skeletal muscle function by reducing protein expression of IGFPI3K-AKT-mTOR pathway. PLoS One. 2018;13 (10):e0199728. Published 2018 Oct 4. doi: 10.1371/journal.pone.0199728
57. Jiao J, Demontis F. Skeletal muscle autophagy and its role in sarcopenia and organismal aging. Curr Opin Pharmacol. 2017;34:1-6. doi: 10.1016/j.coph.2017.03.009
58. Webster BR, Scott I, Traba J, Han K, Sack MN. Regulation of autophagy and mitophagy by nutrient availability and acetylation. Biochim Biophys Acta. 2014;1841 (4):525-34. doi: 10.1016/j.bbalip.2014.02.001
59. Cannataro R, Carbone L, Petro JL, et al. Sarcopenia: Etiology, Nutritional Approaches, and miRNAs. Int J Mol Sci. 2021;22 (18):9724. doi: 10.3390/ijms22189724
Об авторах
И. Е. ПлещёвРоссия
Плещёв Игорь Евгеньевич — старший преподаватель кафедры физической культуры и спорта
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
В. Н. Николенко
Россия
Николенко Владимир Николаевич — д. м. н., проф., зав. кафедрой анатомии человека, ФГАО ВО Первый Московский государственный медицинский университет имени И. М. Сеченова Минздрава России (Сеченовский университет); зав. кафедрой нормальной и топографической анатомии Факультета фундаментальной медицины ФГБОУ ВО «Московский государственный университет им. М. В. Ломоносова»
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Е. Е. Ачкасов
Россия
Ачкасов Евгений Евгеньевич — д. м. н., проф., зав. кафедрой спортивной медицины и медицинской реабилитации
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Н. Шкребко
Россия
Шкребко Александр Николаевич — д. м. н., проф., проректор, зав. кафедрой медицинской реабилитации и спортивной медицины
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Т. Н. Плещёва
Россия
Плещёва Татьяна Николаевна — старший преподаватель кафедры общей гигиены с экологией
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. Б. Бирг
Россия
Бирг Анна Борисовна — студентка 2-го курса
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ч. Синьлян
Россия
Сильнян Чжан — студент 6-го курса
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Д. А. Греков
Россия
Греков Дмитрий Александрович — врач-ординатор кафедры травматологии и ортопедии
Ярославль
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Плещёв И.Е., Николенко В.Н., Ачкасов Е.Е., Шкребко А.Н., Плещёва Т.Н., Бирг А.Б., Синьлян Ч., Греков Д.А. Эффективность нутритивной поддержки и её роль в процессе лечения лиц с саркопенией. Пациентоориентированная медицина и фармация. 2023;1(1):12-22. https://doi.org/10.37489/2949-1924-0003
For citation:
Pleshchev I.E., Nikolenko V.N., Achkasov E.E., Shkrebko A.N., Pleshchevа T.N., Birg A.B., Xinliang Z., Grekov D.A. The efficacy of nutritional support and its role in the treatment of persons with sarcopenia. Patient-Oriented Medicine and Pharmacy. 2023;1(1):12-22. (In Russ.) https://doi.org/10.37489/2949-1924-0003
JATS XML


































.png)
