Перейти к:
Современные методологические подходы к проведению сравнительных исследований реальной клинической практики на примере анализа изучения препаратов ботулотоксина типа А при лечении синдрома спастичности пациентов детского возраста с церебральным параличом
https://doi.org/10.37489/2949-1924-0044
EDN: NUTUUM
Аннотация
Работа посвящена совершенствованию методологических подходов к проведению исследований реальной клинической практики. В качестве примера исследования реальной клинической практики приводится анализ проведённого сравнительного исследования применения в составе медицинской технологии препаратов ботулинического токсина типа А для лечения синдрома спастичности у детей с детским церебральным параличом. Методологические подходы, предложенные в данном исследовании, могут стать основой для организации и проведения сравнительных клинических исследований препаратов одной фармакотерапевтической группы, способствовать формированию рамочных критериев для исследований реальной клинической практики. Внедрение интегративных методологических подходов к проведению клинических исследований в практику призвано способствовать оптимизации фармакотерапии и повышению эффективности системы здравоохранения.
Ключевые слова
Для цитирования:
Архипов В.В., Горячев Д.В., Соловьева А.П. Современные методологические подходы к проведению сравнительных исследований реальной клинической практики на примере анализа изучения препаратов ботулотоксина типа А при лечении синдрома спастичности пациентов детского возраста с церебральным параличом. Пациентоориентированная медицина и фармация. 2024;2(2):7-15. https://doi.org/10.37489/2949-1924-0044. EDN: NUTUUM
For citation:
Arkhipov V.V., Goryachev D.V., Solovyova A.P. Modern methodological approaches to comparative real-world studies using the analysis of botulotoxin A drugs for treating spasticity syndrome in children with cerebral palsy. Patient-Oriented Medicine and Pharmacy. 2024;2(2):7-15. (In Russ.) https://doi.org/10.37489/2949-1924-0044. EDN: NUTUUM
Введение / Introduction
Развитие современной системы фармаконадзора диктует необходимость осуществлять её на основе высокотехнологичных методов экспертизы и требует постоянного совершенствования научных подходов к оценке эффективности и безопасности лекарственных препаратов (ЛП). Это должно способствовать увеличению количества современных ЛП, появлению новых медицинских подходов к лечению ранее инкурабельных заболеваний [1].
Рандомизированные контролируемые предрегистрационные клинические исследования являются «золотым стандартом», дают убедительные доказательства эффективности и безопасности лекарственного препарата.
Предрегистрационные исследования определённо имеют ряд преимуществ перед исследованиями реальной клинической практики (ИРКП). К таким преимуществам следует отнести проспективный сбор информации; заранее заданные, чётко определённые исходы; рандомизация и наличие групп контроля, слепой плацебоконтролируемый характер исследования для получения максимально достоверных результатов. Однако существенным недостатком предрегистрационных исследований является то, что в дальнейшем их невозможно воспроизвести в условиях реальной клинической практики [2].
В связи с этим, наряду с рандомизированными контролируемыми клиническими исследованиями (РКИ) всё больший интерес у производителей лекарственных препаратов и специалистов практического здравоохранения стали вызывать исследования реальной клинической практики.
Согласно определению, данному FDA1 данные реальной клинической практики — это информация о состоянии здоровья пациентов и/или об оказании медицинской помощи, полученные из различных источников вне рамок предрегистрационных РКИ.
Доказательства, собранные в реальной клинической практике2 — это клиническое свидетельство об использовании и потенциальных выгодах или рисках применения технологий здравоохранения, полученное в результате анализа данных реальной клинической практики.
Доказательства из реальной клинической практики характеризуются фактическим опытом применения лекарственного препарата, который можно обобщить для целевой популяции. Доказательства формируются в соответствии с планом исследования, планом статистического анализа и интерпретируются соответствующим образом, тогда как данные являются лишь одним из компонентов плана исследования. Доказательства формируются, в то время как данные просто являются источником и сами по себе не являются информативными [3][4].
Исследование реальной клинической практики (ИРКП) является неинтервенционным исследованием (англ. non-interventional study), при этом решение о назначении препарата обычно основано на утверждённых показаниях к применению в соответствии с рутинной практикой, а соответственно, анализ обычно ведётся на основе базы данных или медицинских карт, в которых уже имеются данные об эффективности и безопасности. Другим вариантом являются проспективные исследования, первичные данные собираются в ходе рутинного лечебного процесса.
Следует понимать, что РКИ далеко не всегда могут помочь в решении вопроса о превосходстве одного ЛП перед другим, особенно если речь идёт о сходных по фармакологическому действию препаратах, относящихся, а нередко и не относящихся к одному классу. Причина этого заключается в отсутствии клинических исследований, посвящённых прямому сравнению таких ЛП между собой. Поскольку различия между близкими по свойствам ЛП могут быть минимальными, для выявления их может потребоваться включение в РКИ огромного количества больных, причём успех в выявлении таких различий вовсе не гарантирован. Инструментом для решения данных проблем может стать внедрение современных организационно-методических моделей исследований реальной клинической практики [6].
Актуальность исследований реальной клинической практики не вызывает сомнений. Однако, разработка дизайна ИРКП требует интегративного комплексного подхода, начиная с формулирования гипотезы, целей и конечных точек исследования, выбора методов исследования и оканчивая тщательной оценкой первичных данных с применением современных методов статистического анализа [5].
Чёткой позиции в отношении степени доказательности данных исследований у регуляторных органов пока нет, но предлагаются рамочные подходы к их проведению. При этом отмечается, что данные ИРКП актуальны, как для исследований безопасности применения ЛС и изучения их сравнительной эффективности, так и для оценки экономической целесообразности использования их в составе комплексных медицинских технологий с учётом региональных особенностей.
Появление на отечественном фармацевтическом рынке различных препаратов ботулотоксина типа А (БТА) и применение при синдроме спастичности при детском церебральном параличе (ДЦП) у детей с 2-х лет, а так же включение препаратов Ботокс®, Диспорт® и Ксеомин® в состав реабилитационной медицинской технологии в ряде учреждений стационарного и амбулаторного звена в РФ, отсутствие данных РКИ по прямому сравнению эффективности и безопасности близких по действию, но не являющихся биоаналогами, препаратов БТА, высокая стоимость комплексной терапии пациентов с ДЦП и социальная значимость данного заболевания стали определяющими факторами для организации и проведения представленного в статье ретроспективного ИРКП.
Спастическая форма ДЦП является самым распространённым и наиболее тяжёлым проявлением этого заболевания [7]. В настоящее время применение препаратов ботулинического токсина типа А для терапии локальной спастичности при ДЦП подтверждено рядом РКИ с уровнем доказательности класса A [8]. Для оценки безопасности и сравнительной эффективности использования различных препаратов БТА был разработан дизайн и осуществлено оригинальное независимое, ретроспективное исследование реальной клинической практики с использованием критериев «эффективность/безопасность» и «затраты/эффективность». Основные положения данного исследования были опубликованы в специализированных медицинских изданиях ранее [9][10], а в настоящее время это исследование демонстрирует вариант независимого ретроспективного сравнительного исследования препаратов различных производителей по зарегистрированному показанию в составе биомедицинской технологии в реальной клинической практики, а методологические подходы, представленные в исследовании, могут быть использованы при проведении подобных исследований.
Цель / objectives: разработать методологические подходы к проведению исследований реальной клинической практики.
Задачи исследования / Research objectives
Дать общие представления об организационном этапе, о разработке дизайна, выборе препаратов и методов исследования для проведения ретроспективного сравнительного ИРКП.
На примере анализа ретроспективного клинического исследования по сравнительной оценке препаратов Ботокс®, Диспорт® и Ксеомин® в комплексной терапии синдрома спастичности у детей с ДЦП дать представление о современных методологических подходах к ретроспективным сравнительным ИРКП.
Предложить актуальные для отечественного здравоохранения методологические подходы для сравнительной комплексной оценки препаратов в рамках ИРКП с использованием критериев «эффективность/безопасность» и «затраты/эффективность».
На основании представленного ИРКП, предложить рамочные критерии и схему организации и проведения ретроспективного сравнительного клинического исследования.
Методы и материалы / Methods and materials
Методологической основой исследования послужили современные принципы исследований реальной клинической практики. Использован информационно-аналитический метод сравнительного анализа норм и требований зарубежных регуляторных систем, законодательства Российской Федерации и правил Евразийского экономического союза.
Актуальные методологические подходы к проведению ИРКП. Особое внимание при подготовке к проведению ИРКП следует уделить подготовительному этапу, при этом следует руководствоваться базисными требованиями Надлежащей клинической практики (ICH GCP) для проведения клинических исследований и другими руководящими документами.
Следует помнить о необходимости надлежащего обоснования актуальности исследования, важно учитывать наличие коммуникативных и административных возможностей, заинтересованности в решении поставленных перед исследователями задач, наличие исполнителей и необходимого материально-технического обеспечения.
Существенную роль в успехе проводимого ИРКП имеет выбор характера ИРКП (проспективное, ретроспективное и т. п.), временных диапазонов и детальная проработка дизайна, позволяющего дать максимально объективную оценку по критерию эффективность при использовании различных ЛП, применяемых по данному показанию, как отдельно, так и в составе комплексной терапии или медицинской технологии.
Так на подготовительном этапе исследования по сравнительной оценке препаратов Ботокс®, Диспорт® и Ксеомин® в комплексной терапии синдрома спастичности у детей с ДЦП мы руководствовались изложенными выше принципами. Был проведён системный анализ по проблематике, дано обоснование целесообразности проведения, поставлены задачи. Исходя из поставленных перед исследованием целей и задач было принято решение о его ретроспективном характере, предложен оригинальный дизайн, получено одобрение локального этического комитета, составлено техническое задание, определён круг исполнителей, исследование внесено в план научно-исследовательских работ, заключён договор о научном сотрудничестве с учреждениями практического здравоохранения, активно занимающиеся данной проблематикой.
Важным этапом работы является выбор препаратов для проведения сравнительного анализа. При выборе лекарственных препаратов (ЛП) следует учитывать ряд факторов: являются ли они зарегистрированными и разрешены к применению по данным показаниям для лечения заболевания или синдрома в качестве монотерапии и/или в составе биомедицинской технологии; при этом они должны быть сопоставимы по механизму действия и/или фармакологическому эффекту от применения; являются ли они воспроизведёнными или биоаналогичными; при этом важно насколько широкое применение имеют в реальной клинической практике.
При обработке результатов ИРКП следует опираться на методологию системного анализа. Для выявления изменений спектра критериев, при оценке результатов исследования следует использовать наиболее чувствительные статистические методы, в том числе целесообразно использование критериев Хи-квадрат, Пирсона, Данна, Фримана-Холтона, дисперсионного анализа Краскела-Уоллиса, непараметрического дисперсионного анализа Фридмана, корреляционного анализа с оценкой точечно-бисериального коэффициента корреляции и с использованием τ-коэффициента Кендалла, методы описательной статистики с учётом вида распределения значений изучаемых параметров.
Особое внимание следует уделять практическому аспекту ИРКП, при этом основным результатом исследования должны стать актуальные для системы здравоохранения рекомендации, позволяющие оптимизировать комплекс лечебных мероприятий и фармакотерапию конкретного заболевания или синдрома.
Анализ ретроспективного исследования реальной клинической практики по сравнительной оценке различных препаратов ботулотоксина типа А при лечении синдрома спастичности у детей. Для проведения анализируемого исследования были выбраны оригинальные препараты различных производителей — Ботокс®, Диспорт® и Ксеомин®, зарегистрированные в РФ и нашедшие широкое применение по показанию лечение синдрома спастичности у детей с ДЦП. При этом указанные препараты сопоставимы по механизму действия (общему для фармакологической группы препаратов ботулотоксина типа А), не являются биоаналогами и отличаются по своему биологическому строению, размерам и структуре (см. рис. 1).

Рис. 1. Схематичное изображение единиц препаратов Ботокс®, Диспорт® и Ксеомин®
Fig. 1. Schematic representation of the units of Botox®, Dysport®, and Xeomin®
В комплексном неинтервенционном ретроспективном исследовании проанализировано 169 карт пациентов в возрасте от 2 до 12 лет с ДЦП, проведён комплексный анализ применения препаратов ботулотоксина типа А у детей с выраженным синдромом спастичности в составе биомедицинской технологии, по критерию «эффективность/безопасность», который включал выделение базисных критериев и их оценку в динамике по данным медицинской документации, при этом одновременно осуществлялся мониторинг актуальных фармакоэкономических критериев в рамках анализа «затраты/эффективность».
У всех пациентов дозы вводимых препаратов не отличались от средних рекомендуемых значений по причине вовлечённости большего или меньшего количества мышечных элементов. Вся сопутствующая комплексная терапия осуществлялась в соответствие со стандартами оказания стационарной и амбулаторной медицинской помощи: «Стандарт первичной медико-санитарной помощи при детском церебральном параличе» и «Стандарт специализированной медицинской помощи при детском церебральном параличе», утверждёнными МЗ РФ. Это имеет крайне важное значение при проведении исследований ИРКП для получения условий, позволяющих проводить сравнение.
Таким образом, анализируя данное исследование, можно сделать вывод, что оно является неинтервенционным, ретроспективным исследованием реальной клинической практики. Все данные по эффективности и безопасности, используемые при оценке, были представлены в первичной медицинской документации. Однако в этом исследовании, несмотря на наличие данных по эффективности терапии в историях болезни необходимо было выбрать наиболее чувствительный параметр эффективности, для получения статистически достоверных результатов. Это свидетельствует о важности при планировании ИРКИ тщательного подход к методологии его проведения. Ещё одним крайне важным аспектом для подобных исследований, который хорошо отражён в исследовании применения препаратов ботулотоксина типа А у детей с выраженным синдромом спастичности, является исследуемая группа пациентов. Охват широкой популяции различной по возрасту и степени тяжести заболевания в исследовании позволяет получить достоверные результаты в исследованиях реальной клинической практики, при этом, помимо прочего позволяет при необходимости провести раздельно сравнение в подгруппах в зависимости от поставленных целей и задач.
Представленное исследование позволяет предложить методологические подходы к проведению сравнительных ретроспективных ИРКП.
На блок-схеме (см. рис. 2) представлены методологические подходы к проведению подобных неинтервенционных сравнительных ретроспективных исследований реальной клинической практики. Эти подходы целесообразны для большинства подобных исследований.
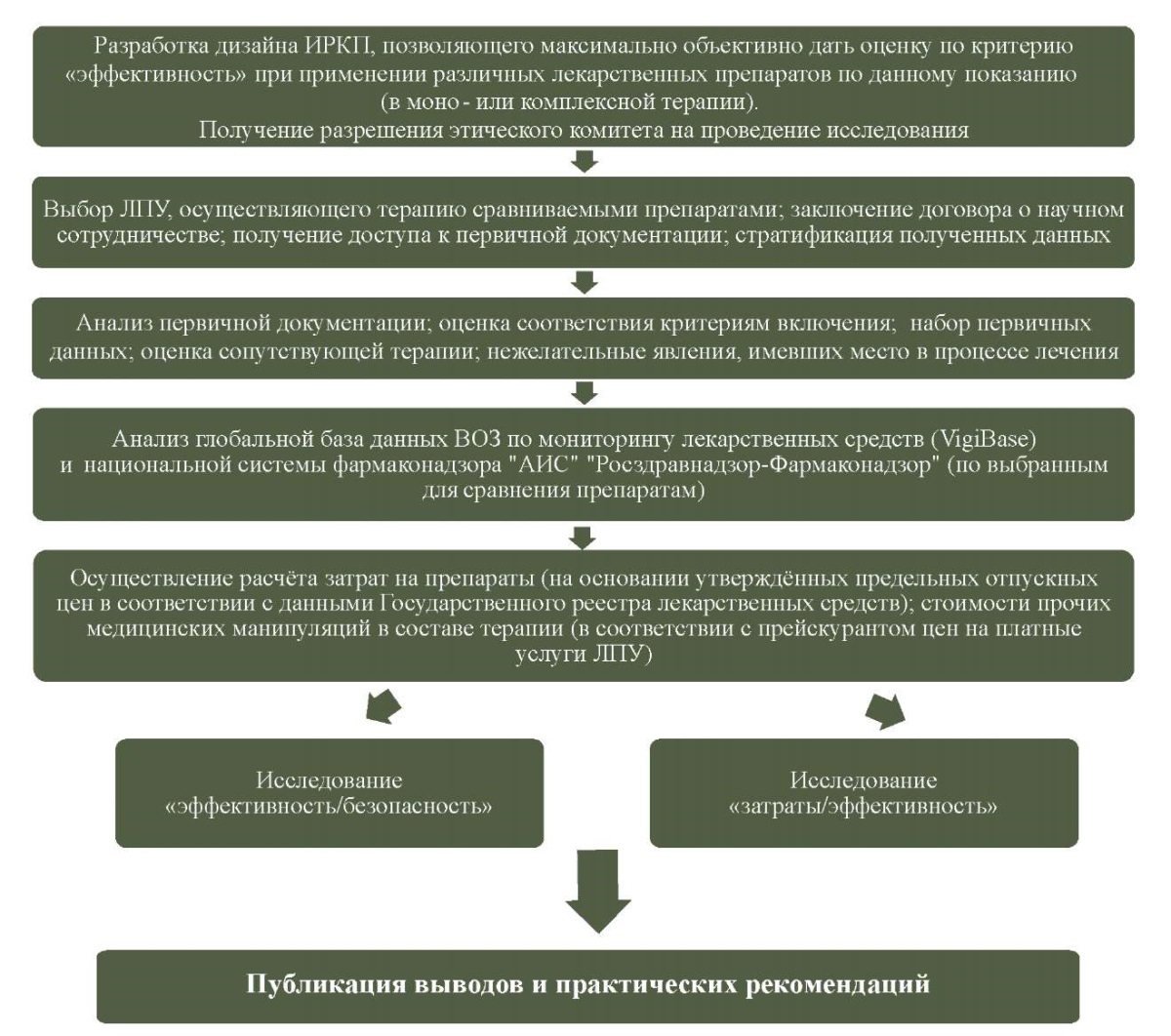
Рис. 2. Пример алгоритма проведения
ретроспективного исследования реальной клинической практики
Fig. 2. Example of an algorithm for conducting a retrospective real-world study
Обсуждение / Discussion
В работе даны представления о подготовительной работе по проведению сравнительного ретроспективного клинического исследования и проведён анализ неинтервенционного исследования, в ходе которого была проведена комплексная сравнительная оценка различных препаратов ботулотоксина типа А, применявшихся по показанию — спастичность у детей в возрасте от 2-х лет и старше при ДЦП в составе современной медицинской реабилитационной технологии.
Преимуществом ИРКП является то, что оценка эффективности при его проведении может проводится при сравнении альтернативных вариантов лечения, что часто позволяет выбрать оптимальный вариант и доказать его преимущества. Крайне важно, что подобные исследования могут включать долгосрочную оценку эффективности и безопасности, включая оценку полипрагмазии у широкого круга пациентов.
Исследования реальной клинической практики актуальны и для проведения клинико-экономического анализа и/или анализа влияния на бюджет ЛП, поэтому подобные исследования применимы, в том числе, при включении того или иного препарата в клинические рекомендации, стандарты медицинской помощи, либо пересмотра ранее принятых [11][12]. В настоящее время данные ИРКП важны при принятии решений при оценке определённой медицинской технологии с целью учёта параметров эффективности и безопасности лечения, характера течения заболевания, качества жизни пациента, а также фармакоэкономических результатов [13].
Исходя из вышеуказанных данных, исследование отечественного опыта применения препаратов БТА соответствует параметрам исследования реальной клинической практики в фармакологии.
Данные, используемые в ИКРП это данные, относящиеся к здоровью пациентов или оказанию медицинской помощи, собираемые из разных источников (RWD). В проведённом исследовании в качестве первичной документации использовались данные медицинских карт, а среди источников для RWD особое значение имеют именно данные медицинских карт в лечебно-профилактических учреждениях. Регуляторными органами FDA и ЕМА это законодательно признано как источник информации, и указано, что применение медицинских карт, в том числе электронных, в конечном итоге приведёт к повышению качества и информативности систем рутинного сбора данных в первичном звене здравоохранения [14].
Одним из требований, предъявляемым к подобным исследованиям, является не только чёткая формулировка цели исследования, конечных точек, плана статистического анализа, но и всесторонняя оценка тех первичных данных, которые будут использованы. Это было продемонстрировано в проведённом исследовании, когда на начальном этапе с использованием метаанализа были валидированы основные оцениваемые параметры, сформулирована основная цель исследования, тщательным образом проведён отбор медицинских карт.
Для обоснования актуальности исследования проведён системный анализ по проблематике, определена цель и поставлены задачи. Исходя из поставленных задач и ретроспективном характере исследования, разработан соответствующий дизайн, составлено техническое задание, заключён договор о научном сотрудничестве с применяющими данную технологию учреждениями практического здравоохранения. Предложен оригинальный алгоритм проведения данного ретроспективного исследования реальной клинической практики, важным методологическим аспектом которого стал выбор критериев оценки эффективности и безопасности лечения синдрома спастичности у детей с ДЦП. Необходимо отметить, что в исследовании была проведена не только сравнительная оценка препаратов ботулинического токсина типа А, а в целом медицинской технологии, одним из компонентов которой стало применение ботулинотерапии, направленной на лечение и реабилитацию детей с церебральным параличом с синдромом спастичности. Общепризнано, что понятие «медицинская технология» включает методы диагностики, лекарственной и нелекарственной терапии, а также реабилитации и профилактики при определённом заболевании в определённой группе пациентов, поэтому оценка эффективности медицинской технологии в ИРКП является одним из важнейших результатов для выбора стратегии лечения, того или иного лекарственного препарата, других методов лечения, и соответственно фармакоэкономических параметров, влияющих в конечно счёте на бюджет здравоохранения. Поэтому проведение ИРКП может быть использовано для решения широкого круга поставленных задач, одной из которых может стать установление среди безопасных и эффективных лекарственных медицинских технологий и, в частности, лекарственных препаратов, экономически наиболее эффективных. Так в данном исследовании при сравнительной комплексной оценке препаратов ботулинического токсина типа А, были показаны преимущества и недостатки комплексной терапии. Таким образом, если одной из задач ИРКП является анализ экономической эффективности в комплексной оценке медицинской технологии, то методология проведения описанного исследования может стать примером дизайна подобных исследований.
В отличии от рандозимированных клинических исследований, длительность в которых часто ограничена, в ИРКП, особенно если исследование носит ретроспективных характер, могут войти данные за длительный период наблюдения, что позволяет оценить долгосрочную эффективность, безопасность и нередко отдалённые последствия терапии, поэтому при планировании подобных исследований целесообразно охватывать большие временные промежутки. При оценке долгосрочной безопасности фармакотерапии частота развития и структура нежелательных явлений важно сопоставлять с данными ВОЗ (VigiBase) и базы Росдравнадзора «АИС» Росздравнадзор-Фармаконадзор» для оценки причинно-следственной связи, выявления ранее не зарегистрированных явлений, получения новых данных по переносимости терапии и лекарственному взаимодействию.
Методология данного исследования может стать алгоритмом для проведения комплексных сравнительных клинических исследований, в том числе препаратов одной фармакологической группы, способствовать выработке рамочных критериев для проведения ретроспективных исследований реальной клинической практики.
В работе предложена универсальная схема организации и поэтапного проведения сравнительных клинических исследований препаратов одной фармакотерапевтической группы, с использованием критериев «эффективность/безопасность», «затраты/эффективность» сформулированы универсальные «рамочные критерии» для подобных клинических исследований.
Следует отметить, что одной из практических целей ИРКП должна стать разработка рекомендаций для практического здравоохранения, позволяющих оптимизировать лечение и проводить рациональную фармакотерапию.
Выводы / Conclusions
Предложенные методологические подходы для сравнительной комплексной оценки с использованием критериев «эффективность/безопасность», «затраты/эффективность» универсальны для проведения пострегистрационных исследований широкого круга лекарственных препаратов, имеющих единые показания к применению, и актуальных для отечественного здравоохранения.
Ретроспективное исследование по сравнительной оценке различных препаратов ботулотоксина типа А при лечении синдрома спастичности у детей иллюстрирует основные методологические подходы и может лежать в основе алгоритма проведению исследований реальной клинической практики, соответствуя рамочным международным критериям, предъявляемым к таким исследованиям.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Участие авторов
Все авторы внесли существенный вклад в подготовку работы, прочли и одобрили финальную версию статьи перед публикацией. Архипов В. В. — концепция и дизайн работы, сбор и обработка материала; Горячев Д. В. — критический анализ, утверждение варианта для публикации; Соловьева А. П. — сбор и обработка материала, написание текста, ответственность за целостность всех частей статьи, выполнение оперативного вмешательства редактирование.
Финансирование
Работа выполнялась без спонсорской поддержки.
ADDITIONAL INFORMATION
Conflict of interests
The authors declare no conflict of interest.
Authors’ participation
All the authors made a significant contribution to the preparation of the work, read and approved the final version of the article before publication. Arkhipov V. V. — concept and design of the work, collection and processing of material; Goryachev D. V. — critical analysis, approval of the version for publication; Solovyova A. P. — collection and processing of material, writing the text, responsibility for the integrity of all parts of the article, performing surgical interventions, editing.
Financing
The work was carried out without sponsorship.
1. U. S. Food and Drug Administration. Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices: Guidance for Industry and Food and Drug Administration Staff. 2017. Accessed July 27, 2020.
2. U. S. Food and Drug Administration. Framework for FDA’s Real-World Evidence Program. 2018. Accessed July 27, 2020.
Список литературы
1. Darrow JJ, Avorn J, Kesselheim AS. FDA Approval and Regulation of Pharmaceuticals, 1983-2018. JAMA. 2020 Jan 14;323(2):164-176. doi: 10.1001/jama.2019.20288. Erratum in: JAMA. 2020 Feb 11;323(6):573.
2. Гольдина Т.А., Колбин А.С., Белоусов Д.Ю., Боровская В.Г. Обзор исследований реальной клинической практики. Качественная клиническая практика. 2021;(1):56-63. https://doi.org/10.37489/2588-0519-2021-1-56-63.
3. Makady A, de Boer A, Hillege H, Klungel O, Goettsch W; (on behalf of GetReal Work Package 1). What Is Real-World Data? A Review of Definitions Based on Literature and Stakeholder Interviews. Value Health. 2017 Jul-Aug;20(7):858-865. doi: 10.1016/j.jval.2017.03.008.
4. Garrison LP Jr, Neumann PJ, Erickson P, Marshall D, Mullins CD. Using real-world data for coverage and payment decisions: the ISPOR Real-World Data Task Force report. Value in Health : the Journal of the International Society for Pharmacoeconomics and Outcomes Research. 2007 Sep-Oct;10(5):326-335. DOI: 10.1111/j.1524-4733.2007.00186.x.
5. Солодовников А.Г., Сорокина Е.Ю., Гольдина Т.А. Данные рутинной практики (real-world data): от планирования к анализу. Медицинские технологии. Оценка и выбор. 2020;(3):9‑16. https://doi.org/10.17116/medtech2020410319.
6. Марцевич С.Ю., Лукина Ю.В., Кутишенко Н.П. Еще раз об иерархии доказательств в медицине, или можно ли с помощью наблюдательных исследований решить вопрос о выборе наиболее эффективного и безопасного препарата. Рациональная Фармакотерапия в Кардиологии. 2017;13(2):270-274.
7. Змановская В.А., Левитина Е.В., Попков Д.А., Буторина М.Н., Павлова О.Л. Длительное применение препарата ботулинического токсина типа А: Диспорт® в комплексной реабилитации детей со спастическими формами паралича. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;7:33-36.
8. Eams NWА, Barker R, Gracham К еt al. The effect of botulinum toxin type А оn gastrocnemius length: magnitude and duration of response. Dev. Med. Child Neurol. 1999;(41):226–232.
9. Соловьева А.П., Архипов В.В., Горячев Д.В. Проведение сравнительной клинико-фармакологической оценки фармакотерапии препаратами ботулинического токсина типа А у детей с детским церебральным параличом с выраженным синдромом спастичности. Российский медицинский журнал. 2019;25(5):293–302.
10. Архипов В.В., Горячев Д.В., Чебаненко Н.В., Соловьева А.П. Проведение сравнительной оценки переносимости и риска фармакотерапии препаратами ботулинического токсина типа А у детей с ДЦП с выраженным синдромом спастичности. Российский медицинский журнал. 2020;26(1):33- 40.
11. Lee W, Dayer V, Jiao B, et al. Use of real-world evidence in economic assessments of pharmaceuticals in the United States. Journal of Managed Care & Specialty Pharmacy. 2021 Jan;27(1):5-14. DOI: 10.18553/jmcp.2021.27.1.005.
12. Борзова М.А. Данные реальной клинической практики: обобщенные регуляторные подходы ЕС и Японии. Реальная клиническая практика: данные и доказательства. 2022;2(1):11-16. https://doi.org/10.37489/2782-3784-myrwd-7
13. Гольдина Т.А., Суворов Н.И. Исследования рутинной клинической практики: от получения данных к оценке медицинских технологий и принятию решений в здравоохранении. Медицинские технологии. Оценка и выбор. 2018;1(31):21-29.
14. Vassall A, Mangham-Jefferies L, Gomez GB, Pitt C, Foster N. Incorporating Demand and Supply Constraints into Economic Evaluations in Low-Income and Middle-Income Countries. Health Econ. 2016 Feb;25 Suppl 1(Suppl Suppl 1):95-115. doi: 10.1002/hec.3306.
Об авторах
В. В. АрхиповРоссия
Архипов Владимир Владимирович — д. м. н., профессор кафедры фармакологии и клинической фармакологии, медицинский факультет
Белгород
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Д. В. Горячев
Россия
Горячев Дмитрий Владимирович — д. м. н., директор
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
А. П. Соловьева
Россия
Соловьева Анна Петровна — к. м. н., главный эксперт управления №2 по эффективности и безопасности лекарственных средств
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Рецензия
Для цитирования:
Архипов В.В., Горячев Д.В., Соловьева А.П. Современные методологические подходы к проведению сравнительных исследований реальной клинической практики на примере анализа изучения препаратов ботулотоксина типа А при лечении синдрома спастичности пациентов детского возраста с церебральным параличом. Пациентоориентированная медицина и фармация. 2024;2(2):7-15. https://doi.org/10.37489/2949-1924-0044. EDN: NUTUUM
For citation:
Arkhipov V.V., Goryachev D.V., Solovyova A.P. Modern methodological approaches to comparative real-world studies using the analysis of botulotoxin A drugs for treating spasticity syndrome in children with cerebral palsy. Patient-Oriented Medicine and Pharmacy. 2024;2(2):7-15. (In Russ.) https://doi.org/10.37489/2949-1924-0044. EDN: NUTUUM
JATS XML


































.png)
