Перейти к:
Развитие 3D-биопечати: от органов до персонализированной медицины
https://doi.org/10.37489/2949-1924-0075
EDN: TTSGSX
Аннотация
Биопечать (биопринтинг) стала революционной технологией в области трансплантации органов и регенеративной медицины, позволяющей решать такие важные проблемы, как нехватка органов и восстановление тканей. В этом обзоре литературы рассматриваются технологические достижения и инновации в области биопечати, освещаются самые современные методы, биоинженерия и их применение в тканевой инженерии. Обсуждаются ключевые этапы создания функциональных тканей, в том числе прототипов органов с васкуляризацией и возможностью трансплантации, а также роль биопечати в персонализированной медицине, где пациентоориентированные модели, революционизируют тестирование лекарств и терапевтические стратегии. Кроме того, в этой статье рассматриваются проблемы и этические соображения, связанные с биопечатью, и даётся представление о её будущем потенциале для преобразования глобального здравоохранения.
Ключевые слова
Для цитирования:
Эскандар К. Развитие 3D-биопечати: от органов до персонализированной медицины. Пациентоориентированная медицина и фармация. 2025;3(1):6-15. https://doi.org/10.37489/2949-1924-0075. EDN: TTSGSX
For citation:
Eskandar K. The rise of 3D bioprinting: from organs to personalized medicine. Patient-Oriented Medicine and Pharmacy. 2025;3(1):6-15. (In Russ.) https://doi.org/10.37489/2949-1924-0075. EDN: TTSGSX
Введение
Биопечать (биопринтинг) –– это инновационный вид 3D-печати, который предполагает послойное нанесение живых клеток и биоматериалов для создания структур, имитирующих сложность естественных тканей и органов. Эта технология использует биоинструменты, состоящие из клеток, факторов роста и биосовместимых материалов, для создания конструкций с точными архитектурными и функциональными свойствами. Этот процесс тщательно контролируется, чтобы обеспечить жизнеспособность и правильное размещение клеток, способствуя разработке тканевых конструкций, которые могут легко интегрироваться в организм человека [1].
Истоки биопечати уходят корнями в развитие технологий 3D-печати. В 1984 году Чарльз Халл (Charles Hull) представил стереолитографию –– метод, который заложил основу для 3D-печати, позволив создавать объекты с помощью последовательного наложения слоёв материалов. Первоначально этот метод нашёл применение в инженерии и производстве. К концу 1990-х годов достижения в области материаловедения привели к разработке биосовместимых материалов, пригодных для медицинского применения, что проложило путь к появлению биопечати [2]. Важная веха была достигнута в 1999 году, когда доктор Энтони Атала (Anthony Atala) и его команда из Института регенеративной медицины Уэйк Форест (Wake Forest Institute for Regenerative Medicine) успешно напечатали каркас для человеческого мочевого пузыря, в который затем были добавлены собственные клетки пациента для создания функционального органа [3]. Этот прорыв продемонстрировал потенциал биопечати в регенеративной медицине. Последующие разработки включали в себя печать миниатюрных функциональных почек в 2002 году и патентование технологии струйной биопечати доктором Томасом Боландом (Thomas Boland) в 2003 году, в которой использовались модифицированные принтеры для внесения клеток в 3D-матрицы [4]. Эти фундаментальные достижения превратили биопечать из концептуальной основы в развивающуюся область со значительными клиническими перспективами.
Важность биопечати в решении проблемы нехватки органов трудно переоценить. Традиционная трансплантация органов сталкивается со значительными трудностями, включая ограниченный запас донорских органов и риск иммунного отторжения. Биопечать предлагает многообещающее решение, позволяя изготавливать органы конкретного пациента с использованием его собственных клеток [5]. Этот подход может не только спасти бесчисленное количество жизней, но и произвести революцию в области регенеративной медицины, предоставляя индивидуальные терапевтические возможности, адаптированные к индивидуальным потребностям пациентов. По мере развития исследований биопечать может стать краеугольным камнем в разработке функциональных тканей и органов, удовлетворяя острую потребность в трансплантации и способствуя развитию персонализированной медицины.
Методология
При проведении этого обзора литературы был применён систематический подход, соответствующий руководящим принципам PRISMA (Предпочтительные элементы отчётности для систематических обзоров и метаанализа), чтобы обеспечить прозрачность и воспроизводимость. Ниже мы приводим полное описание методологии, включая стратегию поиска, критерии включения/исключения, процесс отбора и оценку качества.
Стратегия поиска. Был проведён всесторонний поиск в четырёх основных академических базах данных — PubMed, Google Scholar, Scopus и Web of Science — для выявления соответствующих статей и исследований по биопечати. Для максимального охвата поиск был сосредоточен на следующих ключевых словах и логических комбинациях:
- "Bioprinting"
- "3D Bioprinting"
- "Organ Transplantation"
- "Regenerative Medicine"
- "Personalized Medicine"
- "Bioinks"
- "Vascularization in Bioprinting"
В стратегию поиска были включены синонимы и родственные термины, чтобы обеспечить широкий поиск литературы. Поиск был ограничен рецензируемыми статьями, опубликованными на английском языке в период с 2000 по 2025 год. Стратегия поиска была разработана таким образом, чтобы охватить широту и глубину области, включая технологические, биологические и клинические достижения в области биопечати.
Критерии включения и исключения. При отборе соответствующих исследований для данного обзора были применены следующие критерии включения и исключения:
Критерии включения:
- Публикации в рецензируемых журналах.
- Исследования, посвящённые технологиям и применению биопечати.
- Статьи, посвящённые достижениям в области 3D-биопечати органов, персонализированной и регенеративной медицины.
- Статьи, в которых сообщается об экспериментальных или клинических достижениях в области биопечати.
Критерии исключения:
- Исследования, опубликованные на других языках, кроме английского.
- Статьи, не прошедшие экспертную оценку, материалы конференций и тезисы докладов.
- Статьи с недостаточной методологической проработкой или не относящиеся к тематике.
- Дублирующие публикации, выявленные в нескольких базах данных.
Процесс скрининга и отбора. В результате первоначального поиска была найдена 141 статья. Процесс отбора состоял из трёх этапов:
Этап 1: Удаление дубликатов. С помощью программного обеспечения для управления ссылками все найденные статьи были проверены на наличие повторяющихся записей. После этого шага осталось 83 уникальные статьи.
Этап 2: Проверка названия и аннотации. Названия и аннотации этих статей были независимо проанализированы двумя исследователями. Исследования, которые явно не соответствовали критериям включения, основанным на аннотации, были исключены. В результате этого шага 62 статьи были отобраны.
Этап 3: Полнотекстовый просмотр. Полные тексты остальных 62 статей были оценены на предмет актуальности и качества. Статьи были исключены, если в них отсутствовали надёжные данные, подробная методология или соответствие целям данного обзора. После этой тщательной оценки было отобрано 48 статей для включения в окончательный обзор.
Извлечение данных. Была разработана стандартизированная форма извлечения данных для сбора ключевой информации из каждого исследования, включая:
- Автор(ы) и год публикации
- Дизайн и методология исследования
- Основные результаты и заключения
- Значение биопечати для трансплантации органов и регенеративной медицины
Извлечение данных проводилось двумя экспертами независимо друг от друга для обеспечения точности и согласованности. Любые расхождения устранялись путём обсуждения и достижения консенсуса.
Оценка качества. Качество включённых исследований оценивалось с использованием стандартных инструментов, соответствующих дизайну исследования. Экспериментальные исследования оценивались на предмет методологического качества, включая контроль, воспроизводимость и статистический анализ. Исследования, основанные на вычислениях и моделировании, оценивались на предмет валидации и надёжности. Клинические исследования были проанализированы на предмет соблюдения этических норм, размера выборки и актуальности для практического применения.
Каждому исследованию была присвоена оценка качества на основе заранее определённых критериев, и в обобщающем обзоре были отмечены только высококачественные исследования.
Ограничения методологии. Хотя такой систематический подход обеспечил всесторонний охват данной области, следует признать некоторые ограничения. Во-первых, ограничение поиска публикациями на английском языке могло привести к исключению соответствующих исследований на других языках. Во-вторых, использование рецензируемой литературы могло привести к упущению новых, но неопубликованных результатов в этой области. Наконец, динамичный характер достижений в области биопечати требует постоянного обновления этого обзора по мере поступления новых исследований.
Используя эту систематическую методологию, обзор представляет собой надёжное и прозрачное обобщение текущего состояния и будущих направлений биопечати, рассматривая её вклад в развитие персонализированной и регенеративной медицины.
Блок-схема PRISMA. Для повышения прозрачности приведена блок-схема PRISMA (см. рисунок), иллюстрирующая поэтапный процесс отбора исследований. На диаграмме указано количество выявленных, проверенных, исключённых и включённых записей на каждом этапе, а также причины исключения.
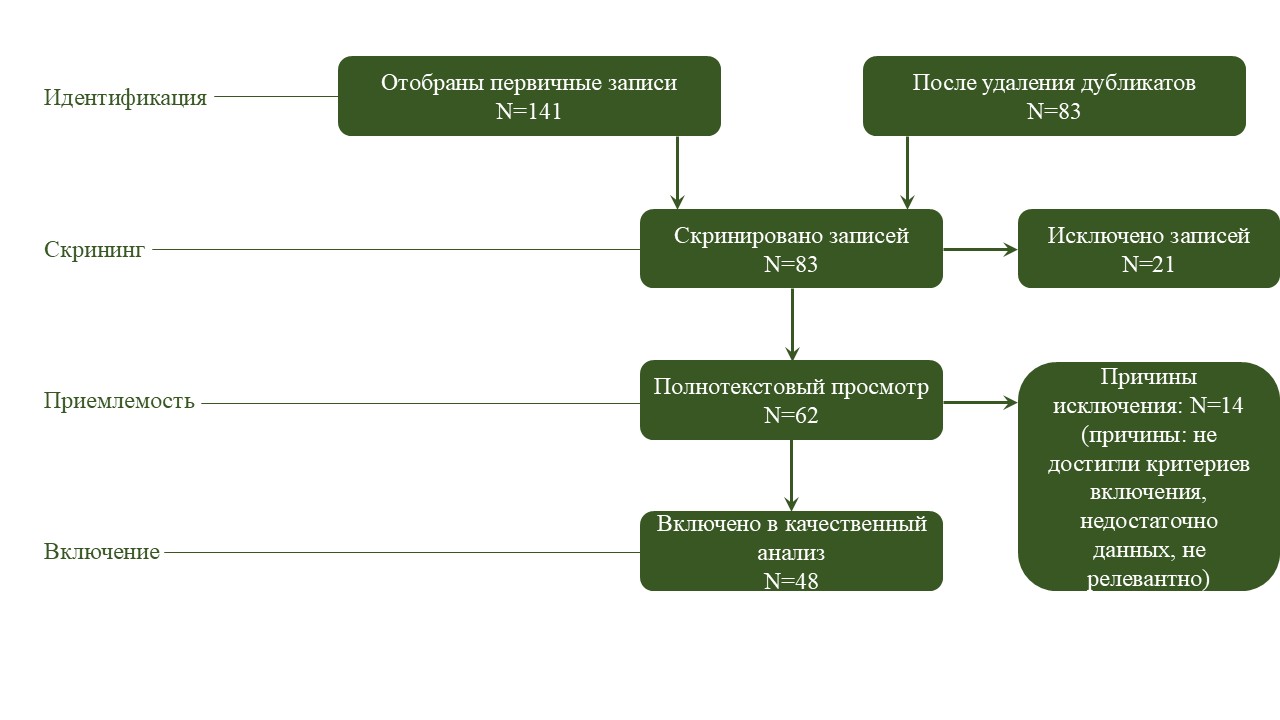
Рис. Блок-схема PRIMSA
Fig. PRIMSA flow diagram
Технологии и приёмы в области биопечати
Биопечать включает в себя ряд методов, предназначенных для создания сложных функциональных биологических структур. Среди основных методов биопечати –– экструзионный метод, метод струйной печати, метод стереолитографии и другие.
Биопечать на основе экструзии предполагает непрерывное нанесение биочернил (англ. bioinks; биоинки) через сопло, что позволяет создавать сложные конструкции, наполненные клетками [6]. Этот метод особенно полезен для изготовления более крупных тканевых структур благодаря его способности печатать с использованием материалов с различной вязкостью.
С другой стороны, при струйной биопечати используются тепловые или акустические воздействия для нанесения капель биочернил на подложку, что позволяет получать расположение клеток и биоматериалов с высоким разрешением. Этот метод отличается скоростью и точностью, что делает его подходящим для применений, требующих детального расположения клеток [7].
Стереолитография использует свет для избирательного отверждения светочувствительных биоплёнок, что облегчает создание структур с исключительным разрешением и сложностью [7]. Этот подход особенно полезен для изготовления каркасов с точными архитектурными характеристиками.
Ключевым фактором успеха этих методов биопечати является выбор подходящих биочернил, которые представляют собой составы из живых клеток и биоматериалов, имитирующих среду внеклеточного матрикса. Биочернила должны обладать свойствами, которые поддерживают жизнеспособность, пролиферацию и дифференцировку клеток, а также обеспечивают механическую целостность, необходимую для напечатанной структуры [8].
Распространённые компоненты биочернил включают природные полимеры, такие как альгинат, желатин и гиалуроновую кислоту, которые обеспечивают биосовместимость и улучшают функции клеток. Синтетические полимеры, такие как полиэтиленгликоль (PEG), также используются для улучшения механических свойств и определения скорости разложения [9]. Выбор биочернил имеет решающее значение, поскольку он влияет на пригодность для печати, структурную стабильность и биологические характеристики биопечатаемой конструкции.
Интеграция каркасов и клеточных матриц в биопечати необходима для воспроизведения сложной архитектуры нативных тканей. Каркасы обеспечивают трёхмерную структуру, которая поддерживает прикрепление клеток и направляет развитие тканей. В некоторых подходах к биопечати синтетические материалы печатаются таким образом, чтобы сформировать формы или жёсткие слои, которые содержат биочернила, предотвращающие их растекание и сохраняющий желаемую форму конструкции [10]. Эти каркасы могут быть сконструированы таким образом, чтобы со временем разрушаться, позволяя развивающейся ткани заменять материал каркаса по мере его созревания. Комбинация каркасов с биочернилами, насыщенными клетками, позволяет создавать тканевые конструкции, которые точно имитируют структурные и функциональные свойства природных тканей, продвигая развитие регенеративной медицины [11].
Последние инновации и прорывы
Недавние достижения в области биопечати значительно продвинули эту область в направлении создания функциональных тканей и органов, решая важнейшие задачи регенеративной медицины. Инновации в методах биопечати позволили создавать сложные структуры тканей, которые в точности повторяют их естественные аналоги [12]. Например, исследователи разработали методы биопечати ткани с интегрированными сосудистыми сетями, повышающие жизнеспособность и функциональность конструкций. Эти разработки имеют решающее значение для преодоления прежних ограничений, связанных с толщиной тканей и диффузией питательных веществ [13].
Заметный прогресс был достигнут в биопечати прототипов органов, таких как почки, печень и сердце. В 2024 году исследование биопечати тканей печени со сложной сосудистой архитектурой продемонстрировало важные функции печени и её чувствительность к медикаментозному лечению [14]. Аналогичным образом, достижения в области тканевой инженерии привели к успешной биопечати тканей сердца, которые демонстрируют синхронизированные сокращения и электрофизиологические свойства, сходные с нативной сердечной тканью [15]. Эти прототипы представляют собой важные вехи на пути к разработке полнофункциональных биопечатаемых органов для трансплантации.
Несмотря на эти препятствия, в области биопечати для трансплантации органов были достигнуты заметные успехи. Например, исследователи успешно напечатали образцы ткани печени, которые демонстрируют ключевые функции печени, такие как выработка альбумина и активность фермента цитохрома Р450, что указывает на потенциал для тестирования лекарственных препаратов и моделирования заболеваний [25]. Достижения в области тканевой инженерии сердца привели к биопечати тканей сердца, демонстрирующих синхронизированные сокращения и электрофизиологические свойства, сходные с нативным миокардом. Эти разработки представляют собой важные шаги на пути к созданию биопечатаемых органов, пригодных для трансплантации [26].
Важнейшим аспектом биопечати функциональных тканей является включение сосудистых сетей для обеспечения адекватного снабжения питательными веществами и кислородом. Недавние исследования были сосредоточены на синергетическом взаимодействии между стратегиями 3D-биопечати и васкуляризации для повышения жизнеспособности тканей. Например, исследователи изучили использование градиентов факторов роста и систем совместного культивирования для содействия формированию иерархических сосудистых сетей в биопечатаемых тканях [16]. Кроме того, для создания синтетической сосудистой сети органного масштаба были использованы подходы компьютерного моделирования, облегчающие биомеханическое производство более крупных и сложных тканевых конструкций. Эти усилия имеют решающее значение для решения проблем, связанных с васкуляризацией биопечатаемых тканей, тем самым приближая эту область к созданию пригодных для трансплантации биопечатаемых органов [17].
Применение в регенеративной медицине
Биопечать стала революционным подходом в регенеративной медицине, предлагающим инновационные решения для тканевой инженерии и заживления ран. Благодаря точному размещению клеток и биоматериалов биопечать позволяет создавать сложные тканевые конструкции, которые точно имитируют естественные ткани. Эта технология облегчает разработку индивидуальных трансплантатов, адаптированных к конкретным потребностям пациента, тем самым повышая эффективность лечения различных травм и дегенеративных состояний [18].
В области регенерации костей и хрящей биопечать продемонстрировала значительный потенциал. Используя биочернила, состоящие из клеток и вспомогательных биоматериалов, исследователи успешно изготовили конструкции, которые способствуют регенерации костной и хрящевой тканей [19]. Эти биопечатные структуры создают благоприятную среду для пролиферации и дифференцировки клеток, что приводит к восстановлению функций повреждённых тканей скелета. Этот подход обещает решить проблемы, связанные с дефектами костей и повреждениями хрящей, и открывает путь к улучшению результатов лечения пациентов [20].
Биопечать кожи представляет собой значительный прогресс в лечении ожоговых травм. Традиционные методы пересадки кожи часто сталкиваются с такими ограничениями, как болезненность донорского участка и ограниченная доступность здоровых тканей. Биопечать предлагает многообещающую альтернативу, позволяя изготавливать кожные конструкции, которые могут быть адаптированы к геометрии раны пациента [21]. Этот подход не только ускоряет процесс заживления, но и улучшает эстетические и функциональные результаты для пострадавших от ожогов. Недавние исследования показали потенциал биопечатаемых заменителей кожи в ускорении заживления ран и уменьшении образования рубцов, тем самым повышая качество жизни пациентов с тяжёлыми ожогами [22].
Биопечать для трансплантации органов
Биопечать имеет значительные перспективы для трансплантации органов, однако ряд проблем препятствует созданию полностью функциональных органов, пригодных для трансплантации. Одним из основных препятствий является воспроизведение сложной сосудистой сети, необходимой для доставки необходимых для жизни питательных веществ и кислорода к органам и клеткам, а также выведение ненужных продуктов обмена. Достижение необходимой плотности клеток и пространственной организации для имитации функциональности естественных тканей остаётся сложной задачей [23]. Кроме того, обеспечение механической целостности и долгосрочной жизнеспособности напечатанных органов представляет значительные трудности. Выбор подходящих опор, которые поддерживают пролиферацию и дифференцировку клеток, сохраняя при этом способность к печати и структурную стабильность, имеет решающее значение. Интеграция биопечатаемых конструкций с биологическими системами организма-хозяина, включая иммунную совместимость и создание функциональных интерфейсов с существующими тканями, представляет дополнительные проблемы [24].
Неоспоримым преимуществом биопечати является её способность предотвращать отторжение органов. Используя собственные клетки пациента для создания биочернил, можно адаптировать напечатанные на биопринтере органы к уникальному генетическому и иммунологическому профилю человека, тем самым снижая риск иммунного отторжения [27]. Такой индивидуальный подход не только повышает биосовместимость, но и устраняет необходимость в иммуносупрессивной терапии, которая связана с неблагоприятными побочными эффектами и повышенной восприимчивостью к инфекциям. Кроме того, биопечать позволяет точно контролировать пространственное распределение клеток и биоматериалов, позволяя создавать тканевые конструкции, которые точно имитируют естественную архитектуру и функции органов [28]. Такая точность способствует разработке более эффективных и долговечных методов замены органов, устраняя ограничения современных методов трансплантации.
Роль в персонализированной медицине
Биопечать стала ключевой технологией в персонализированной медицине, позволяющей создавать ткани и органы в соответствии с индивидуальными требованиями пациента. Используя собственные клетки пациента, биопечать облегчает создание индивидуальных тканевых конструкций, которые соответствуют индивидуальным анатомическим и физиологическим особенностям, тем самым повышая эффективность терапевтических вмешательств [29]. Такой подход не только улучшает результаты лечения, но и сводит к минимуму риск иммунного отторжения, поскольку биоткани по своей сути совместимы с иммунной системой пациента.
В области тестирования лекарств и моделирования заболеваний биопечать предлагает значительные преимущества. Традиционные методики тестирования лекарств часто основаны на моделях на животных, которые могут неточно воспроизводить физиологические реакции человека, что приводит к потенциальным расхождениям в показателях эффективности и токсичности лекарств [30]. Напечатанные на биопринтере модели тканей человека обеспечивают более точную платформу для оценки реакции на лекарственные препараты, тем самым снижая зависимость от тестирования на животных и повышая прогностическую достоверность доклинических исследований [31]. Кроме того, эти биопечатные модели могут быть адаптированы для представления конкретных болезненных состояний, что позволяет проводить более точные исследования механизмов заболевания и разрабатывать целенаправленные методы лечения.
Проблемы и ограничения
Биопечать, хотя и является многообещающей, сталкивается с рядом технологических и биологических проблем, которые препятствуют её продвижению к клиническому применению. Существенной проблемой является масштабируемость; изготовление тканей и органов человеческого размера требует длительного времени печати, в течение которого поддержание жизнеспособности клеток становится сложной задачей [34]. Длительное воздействие факторов окружающей среды во время длительной печати может поставить под угрозу здоровье клеток, что приводит к снижению функциональности напечатанных тканей [35].
Кроме того, трудоёмкость создания тканей со сложной структурой создаёт существенные препятствия. Достижение необходимой плотности клеток и пространственной организации для имитации функциональности естественных тканей остаётся сложной задачей [36]. Выбор подходящих опор, которые поддерживают пролиферацию и дифференцировку клеток, сохраняя при этом пригодность для печати и структурную стабильность, имеет решающее значение [37].
Проблемы, связанные с регулированием и клиническими испытаниями, ещё больше усложняют развитие технологий биопечати. Многогранный характер биопечатаемых продуктов, которые сочетают в себе аспекты 3D-печати, клеточной терапии и специальных имплантатов, представляет собой уникальную проблему для существующей нормативно-правовой базы [38]. Действующие нормативные акты могут неадекватно учитывать сложности, присущие биопечати тканей, что требует разработки новых руководящих принципов для обеспечения безопасности и эффективности.
Стоимость и доступность также создают значительные препятствия для широкого внедрения технологий биопечати. Высокие затраты, связанные с оборудованием, материалами и специализированным персоналом для биопечати, ограничивают доступность, особенно в условиях ограниченных ресурсов [39]. Этот экономический барьер может усугубить существующие диспропорции в здравоохранении, ограничивая преимущества биопечати для хорошо финансируемых учреждений и населения. Решение этих проблем с затратами и доступностью имеет решающее значение для справедливого внедрения биопечати в клиническую практику [32].
Этические, юридические и социальные последствия
Появление технологии биопечати, особенно при изготовлении тканей и органов человека, влечёт за собой целый комплекс этических, юридических и социальных последствий, которые требуют тщательного изучения.
Внедрение биопечати для конкретного пациента также поднимает важные этические вопросы. Такие вопросы, как получение клеток, согласие на их использование и долгосрочные последствия создания тканей с биопечатью, требуют тщательного обсуждения [32]. Кроме того, необходимо учитывать потенциальную возможность использования биопечати для усиления диспропорций в области здравоохранения, особенно если доступ к таким передовым методам лечения ограничен определёнными группами населения. Необходимо совершенствовать нормативную базу, чтобы обеспечить этичное применение технологий биопечати, сочетая инновации с безопасностью пациентов и равноправным доступом [33].
С этической точки зрения создание человеческих тканей и органов с помощью биопечати поднимает вопросы о моральных границах научного вмешательства в естественные биологические процессы. Хотя эта технология обещает облегчить проблему нехватки органов, она также вызывает опасения по поводу превращения человеческой жизни в товар и возможности создания объектов, которые бросают вызов нашим представлениям о личности [40]. Кроме того, использование человеческих клеток для биопечати требует тщательного рассмотрения вопроса о согласии донора и соблюдении этических норм при выборе биологических материалов [41].
С юридической точки зрения биопечать связана со сложными вопросами интеллектуальной собственности. Определение патентоспособности материалов для биопечати является сложной задачей, поскольку традиционные патентные системы часто исключают продукты, полученные в результате природных явлений. Эта неопределённость усложняет защиту инноваций в области биопечати и может препятствовать развитию отрасли [42]. Кроме того, остаётся нерешённой проблема классификации биопечатных органов, в соответствии с существующими правовыми рамками. Например, если органы, полученные с помощью биопечати, считаются эквивалентными натуральным человеческим органам, они могут подпадать под действие таких нормативных актов, как на закон о трансплантации органов, который запрещает продажу человеческих органов, тем самым влияя на коммерциализацию продуктов, полученных с помощью биопечати [32].
В социальном плане биопечать может существенно повлиять на глобальную справедливость в области здравоохранения. Высокие затраты, связанные с технологиями биопечати, могут ограничить доступ к передовым методам лечения, особенно в условиях нехватки ресурсов, тем самым усугубляя существующее неравенство в области здравоохранения [33]. Более того, возможность производства человеческих тканей и органов может привести к общественным дебатам относительно определения жизни и морального статуса объектов, напечатанных на биопринтере. Эти дискуссии требуют широкого участия общественности, чтобы ответственно относиться к общественным последствиям биопечати [43].
Будущие направления
Область биопечати ожидает значительный прогресс, обусловленный новыми тенденциями, такими как интеграция искусственного интеллекта (ИИ) и робототехники. Конвергенция ИИ с биопечатью позволяет анализировать сложные биологические данные, облегчая разработку более точных и функциональных тканевых конструкций [44]. Алгоритмы ИИ могут оптимизировать параметры печати в режиме реального времени, повышая точность и эффективность процесса биопечати. Кроме того, внедрение роботизированных систем, в частности, 3D-биопечати на базе роботизированной руки, обеспечивает повышенную автоматизацию и точность, позволяя создавать сложные тканевые структуры с высокой пространственной точностью [45].
Междисциплинарное сотрудничество играет ключевую роль в развитии технологий биопечати. Объединение опыта в таких областях, как биология, инженерия, материаловедение и информатика, способствует инновациям и решению многогранных задач, присущих биопечати [46]. Этот совместный подход, часто называемый биоконвергенцией, использует различные методологии для решения сложных проблем в регенеративной медицине и за её пределами.
Заглядывая вперёд, можно ожидать, что в следующем десятилетии в области биопечати и регенеративной медицины произойдут кардинальные изменения. Ожидается, что достижения в области искусственного интеллекта и робототехники приведут к дальнейшему совершенствованию методов биопечати, что позволит создавать более сложные и функциональные ткани и органы [47]. Более того, продолжающаяся интеграция междисциплинарных подходов, вероятно, приведёт к инновационным решениям существующих проблем, таких как васкуляризация. Эти разработки обещают приблизить биопечать к клиническим применениям, потенциально революционизируя персонализированную медицину и решая проблему глобальной нехватки органов, пригодных для трансплантации [48].
Заключение
В заключение следует отметить, что биопечать стала новаторской технологией с огромным потенциалом для революционизирования медицины, решения важнейших задач в области трансплантации органов, регенеративной и персонализированной медицины.
В этом обзоре литературы рассматриваются основополагающие принципы, технологические достижения и области применения биопечати, а также проливается свет на этические, юридические и социальные последствия. Интеграция передовых технологий, таких как искусственный интеллект и робототехника, наряду с междисциплинарным сотрудничеством, прокладывает путь к революционным прорывам в этой области. Несмотря на то, что такие проблемы, как масштабируемость, васкуляризация, нормативные препятствия и равный доступ, остаются значительными, текущие исследования и инновации продолжают расширять границы возможного.
Представляя будущее, в котором ткани и органы, напечатанные на биопринтере, станут широко доступными, эта область обещает устранить пробелы в мировом здравоохранении, вселяя надежду на улучшение результатов лечения пациентов и начало новой эры в регенеративной и персонализированной медицины.
Список литературы
1. Persaud A, Maus A, Strait L, Zhu D. 3D Bioprinting with Live Cells. Engineered Regeneration. 2022;3(3):292–309. https://doi.org/10.1016/j.engreg.2022.07.002
2. Gu Z, Fu J, Lin H, He Y. Development of 3D bioprinting: From printing methods to biomedical applications. Asian Journal of Pharmaceutical Sciences. 2019;15(5):529–557. https://doi.org/10.1016/j.ajps.2019.11.003
3. Atala A, Bauer SB, Soker S, Yoo JJ, Retik AB. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 2006 Apr 15;367(9518):1241-6. doi: 10.1016/S0140-6736(06)68438-9.
4. Mierke CT. Bioprinting of Cells, Organoids and Organs-on-a-Chip Together with Hydrogels Improves Structural and Mechanical Cues. Cells. 2024 Oct 1;13(19):1638. doi: 10.3390/cells13191638. https://doi.org/10.3390/cells13191638
5. de Jongh D, Massey EK, Cronin AJ, Schermer MHN, Bunnik EM; VANGUARD Consortium. Early-Phase Clinical Trials of Bio-Artificial Organ Technology: A Systematic Review of Ethical Issues. Transpl Int. 2022 Oct 31;35:10751. doi: 10.3389/ti.2022.10751.
6. Fang Y, Guo Y, Liu T, Xu R, Mao S, Mo X, Zhang T, Ouyang L, Xiong Z, Sun W. Advances in 3D bioprinting. Chinese Journal of Mechanical Engineering Additive Manufacturing Frontiers. 2022;1(1):100011. https://doi.org/10.1016/j.cjmeam.2022.100011
7. Budharaju H, Sundaramurthi D, Sethuraman S. Embedded 3D bioprinting - An emerging strategy to fabricate biomimetic & large vascularized tissue constructs. Bioact Mater. 2023 Oct 21;32:356-384. doi: 10.1016/j.bioactmat.2023.10.012.
8. Chen XB, Fazel Anvari-Yazdi A, Duan X, Zimmerling A, Gharraei R, Sharma NK, Sweilem S, Ning L. Biomaterials / bioinks and extrusion bioprinting. Bioact Mater. 2023 Jun 27;28:511-536. doi: 10.1016/j.bioactmat.2023.06.006.
9. Brahme P, Rarokar N, Kumbhalkar R, Saoji S, Khedekar P. Natural and synthetic polymeric hydrogel: a bioink for 3D bioprinting of tissue models. Journal of Drug Delivery Science and Technology. 2024; 106204. https://doi.org/10.1016/j.jddst.2024.106204
10. Do AV, Khorsand B, Geary SM, Salem AK. 3D Printing of Scaffolds for Tissue Regeneration Applications. Adv Healthc Mater. 2015 Aug 26;4(12):1742-62. doi: 10.1002/adhm.201500168.
11. Selim M, Mousa HM, Abdel-Jaber G, Barhoum A, Abdal-Hay A. Innovative designs of 3D scaffolds for bone tissue regeneration: Understanding principles and addressing challenges. European Polymer Journal. 2024;215:113251. https://doi.org/10.1016/j.eurpolymj.2024.113251
12. Mirshafiei M, Rashedi H, Yazdian F, Rahdar A, Baino F. Advancements in tissue and organ 3D bioprinting: Current techniques, applications, and future perspectives. Materials & Design. 2024;240:112853. https://doi.org/10.1016/j.matdes.2024.112853
13. Datta P, Ayan B, Ozbolat IT. Bioprinting for vascular and vascularized tissue biofabrication. Acta Biomater. 2017 Mar 15;51:1-20. doi: 10.1016/j.actbio.2017.01.035.
14. Wang X, Zhang D, Singh YP, Yeo M, Deng G, Lai J, Chen F, Ozbolat IT, Yu Y. Progress in Organ Bioprinting for Regenerative Medicine. Engineering. 2024;42(11):121‒142. https://doi.org/10.1016/j.eng.2024.04.023
15. Cui H, Miao S, Esworthy T, Zhou X, Lee SJ, Liu C, Yu ZX, Fisher JP, Mohiuddin M, Zhang LG. 3D bioprinting for cardiovascular regeneration and pharmacology. Adv Drug Deliv Rev. 2018 Jul;132:252-269. doi: 10.1016/j.addr.2018.07.014.
16. Yeo M, Sarkar A, Singh YP, Derman ID, Datta P, Ozbolat IT. Synergistic coupling between 3D bioprinting and vascularization strategies. Biofabrication. 2023 Nov 20;16(1):012003. doi: 10.1088/1758-5090/ad0b3f.
17. Sexton ZA, Hudson AR, Herrmann JE, Shiwarski DJ, Pham J, Szafron JM, Wu SM, Skylar-Scott M, Feinberg AW, Marsden A. Rapid model-guided design of organ-scale synthetic vasculature for biomanufacturing. ArXiv [Preprint]. 2023 Aug 15:arXiv:2308.07586v1.
18. Tripathi S, Mandal SS, Bauri S, Maiti P. 3D bioprinting and its innovative approach for biomedical applications. MedComm (2020). 2022 Dec 24;4(1):e194. doi: 10.1002/mco2.194.
19. Chiticaru EA, Ioniță M. Commercially available bioinks and state-of-the-art lab-made formulations for bone tissue engineering: A comprehensive review. Mater Today Bio. 2024 Nov 14;29:101341. doi: 10.1016/j.mtbio.2024.101341.
20. Zhou J, Li Q, Tian Z, Yao Q, Zhang M. Recent advances in 3D bioprinted cartilage-mimicking constructs for applications in tissue engineering. Mater Today Bio. 2023 Nov 17;23:100870. doi: 10.1016/j.mtbio.2023.100870.
21. Varkey M, Visscher DO, van Zuijlen PPM, Atala A, Yoo JJ. Skin bioprinting: the future of burn wound reconstruction? Burns Trauma. 2019 Feb 12;7:4. doi: 10.1186/s41038-019-0142-7.
22. Kolimi P, Narala S, Nyavanandi D, Youssef AAA, Dudhipala N. Innovative Treatment Strategies to Accelerate Wound Healing: Trajectory and Recent Advancements. Cells. 2022 Aug 6;11(15):2439. doi: 10.3390/cells11152439.
23. Huang G, Zhao Y, Chen D, Wei L, Hu Z, Li J, Zhou X, Yang B, Chen Z. Applications, advancements, and challenges of 3D bioprinting in organ transplantation. Biomaterials Science. 2024;12(6):1425–1448. https://doi.org/10.1039/d3bm01934a
24. Mathur V, Agarwal P, Kasturi M, Srinivasan V, Seetharam RN, Vasanthan KS. Innovative bioinks for 3D bioprinting: Exploring technological potential and regulatory challenges. Journal of Tissue Engineering. 2025;16. doi:10.1177/20417314241308022
25. Mota C, Camarero-Espinosa S, Baker MB, Wieringa P, Moroni L. Bioprinting: From Tissue and Organ Development to in Vitro Models. Chem Rev. 2020 Oct 14;120(19):10547-10607. doi: 10.1021/acs.chemrev.9b00789.
26. Wang Z, Wang L, Li T, Liu S, Guo B, Huang W, Wu Y. 3D bioprinting in cardiac tissue engineering. Theranostics. 2021 Jul 6;11(16):7948-7969. doi: 10.7150/thno.61621.
27. Yaneva A, Shopova D, Bakova D, Mihaylova A, Kasnakova P, Hristozova M, Semerdjieva M. The Progress in Bioprinting and Its Potential Impact on Health-Related Quality of Life. Bioengineering (Basel). 2023 Aug 1;10(8):910. doi: 10.3390/bioengineering10080910.
28. Shopova D, Yaneva A, Bakova D, Mihaylova A, Kasnakova P, Hristozova M, Sbirkov Y, Sarafian V, Semerdzhieva M. (Bio)printing in Personalized Medicine-Opportunities and Potential Benefits. Bioengineering (Basel). 2023 Feb 23;10(3):287. doi: 10.3390/bioengineering10030287.
29. Lam EHY, Yu F, Zhu S, Wang Z. 3D Bioprinting for Next-Generation Personalized Medicine. Int J Mol Sci. 2023 Mar 28;24(7):6357. doi: 10.3390/ijms24076357.
30. Parihar A, Parihar DS, Gaur K, Arya N, Choubey VK, Khan R. 3D bioprinting for drug development and screening: Recent trends towards personalized medicine. Hybrid Advances. 2024; 100320. https://doi.org/10.1016/j.hybadv.2024.100320
31. Yang K, Wang L, Vijayavenkataraman S, Yuan Y, Tan E, Kang L. Recent applications of three-dimensional bioprinting in drug discovery and development. Advanced Drug Delivery Reviews. 2024; 115456. https://doi.org/10.1016/j.addr.2024.115456
32. Ricci G, Gibelli F, Sirignano A. Three-Dimensional Bioprinting of Human Organs and Tissues: Bioethical and Medico-Legal Implications Examined through a Scoping Review. Bioengineering (Basel). 2023 Sep 7;10(9):1052. doi: 10.3390/bioengineering10091052.
33. Kantaros A, Ganetsos T, Petrescu FIT, Alysandratou E. Bioprinting and Intellectual Property: Challenges, Opportunities, and the Road Ahead. Bioengineering (Basel). 2025 Jan 15;12(1):76. doi: 10.3390/bioengineering12010076.
34. Vijayavenkataraman S. (2023). 3D bioprinting: challenges in commercialization and clinical translation. Journal of 3D Printing in Medicine, 7(2). https://doi.org/10.2217/3dp-2022-0026
35. Xu HQ, Liu JC, Zhang ZY, Xu CX. A review on cell damage, viability, and functionality during 3D bioprinting. Military Medical Research, 2022;9(1): 70. https://doi.org/10.1186/s40779-022-00429-5
36. Derman ID, Moses JC, Rivera T, Ozbolat IT. Understanding the cellular dynamics, engineering perspectives and translation prospects in bioprinting epithelial tissues. Bioact Mater. 2024 Sep 24;43:195-224. doi: 10.1016/j.bioactmat.2024.09.025.
37. Hasan MM, Ahmad A, Akter MZ, Choi YJ, Yi HG. Bioinks for bioprinting using plant-derived biomaterials. Biofabrication. 2024 Aug 22;16(4). doi: 10.1088/1758-5090/ad6932.
38. Mladenovska T, Choong PF, Wallace GG, O'Connell CD. The regulatory challenge of 3D bioprinting. Regen Med. 2023 Aug;18(8):659-674. doi: 10.2217/rme-2022-0194.
39. Tong A, Pham QL, Abatemarco P, Mathew A, Gupta D, Iyer S, Voronov R. Review of Low-Cost 3D Bioprinters: State of the market and observed future trends. SLAS TECHNOLOGY. 2021;26(4):333–366. https://doi.org/10.1177/24726303211020297
40. Kirillova A, Bushev S, Abubakirov A, Sukikh G. Bioethical and Legal Issues in 3D Bioprinting. Int J Bioprint. 2020 Apr 28;6(3):272. doi: 10.18063/ijb.v6i3.272.
41. Gilbert F, O'Connell CD, Mladenovska T, Dodds S. Print Me an Organ? Ethical and Regulatory Issues Emerging from 3D Bioprinting in Medicine. Sci Eng Ethics. 2018 Feb;24(1):73-91. doi: 10.1007/s11948-017-9874-6.
42. Devarapalli P, & Ajay D. (2024). The impact of 3D bioprinting innovation on IP ecosystem and patent Law: An Indian and US perspective. In Science, Technology and Innovation Ecosystem: An Indian and Global Perspective (pp. 197–210). https://doi.org/10.1007/978-981-97-2815-2_9
43. Vijayavenkataraman S, Lu W, Fuh J. 3D bioprinting – An Ethical, Legal and Social Aspects (ELSA) framework. Bioprinting. 2016;(1–2):11–21. https://doi.org/10.1016/j.bprint.2016.08.001
44. Zhang Z, Zhou X, Fang Y, Xiong Z, Zhang T. AI-driven 3D bioprinting for regenerative medicine: From bench to bedside. Bioactive Materials. 2024;45:201–230. https://doi.org/10.1016/j.bioactmat.2024.11.021
45. Barjuei ES, Shin J, Kim K, Lee J. Precision improvement of robotic bioprinting via vision-based tool path compensation. Sci Rep. 2024 Aug 1;14(1):17764. doi: 10.1038/s41598-024-68597-z.
46. Aljohani W, Ullah MW, Zhang X, Yang G. Bioprinting and its applications in tissue engineering and regenerative medicine. Int J Biol Macromol. 2018 Feb;107 (Pt A):261-275. doi: 10.1016/j.ijbiomac.2017.08.171.
47. Jain P, Kathuria H, Dubey N. Advances in 3D bioprinting of tissues/organs for regenerative medicine and in-vitro models. Biomaterials. 2022 Aug;287:121639. doi: 10.1016/j.biomaterials.2022.121639.
48. Jovic TH, Combellack EJ, Jessop ZM, Whitaker IS. 3D Bioprinting and the Future of Surgery. Front Surg. 2020 Nov 27;7:609836. doi: 10.3389/fsurg.2020.609836.
Об авторе
Киролос ЭскандарЕгипет
Киролос Эскандар — факультет медицины и хирургии
Каир
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
Рецензия
Для цитирования:
Эскандар К. Развитие 3D-биопечати: от органов до персонализированной медицины. Пациентоориентированная медицина и фармация. 2025;3(1):6-15. https://doi.org/10.37489/2949-1924-0075. EDN: TTSGSX
For citation:
Eskandar K. The rise of 3D bioprinting: from organs to personalized medicine. Patient-Oriented Medicine and Pharmacy. 2025;3(1):6-15. (In Russ.) https://doi.org/10.37489/2949-1924-0075. EDN: TTSGSX
JATS XML


































.png)
